.
|
|
La spirée
(appelée aussi « reine des prés ») est une plante vivace des zones
humides. Sa tige, haute de 50 cm à 1,50 m, est surmontée d'une grappe
de fleurs, de couleur crème, au parfum doux. Les fleurs contiennent de
l'acide spirique plus connu sous le nom d’acide salicylique utilisé
pour ses propriétés anti-inflammatoires, son action apaisante lors de
douleurs articulaires et ses propriétés verrucides.
Etude
de l'acidité d'une solution d'acide salicylique.
On note AH la molécule d'acide salicylique de formule brute C7H6O3. On
prépare une solution aqueuse d'acide salicylique de concentration molaire C =
1,0×10-2 mol.L-1. On mesure le pH de la solution à 25°C : pH = 2,6.
Définir un acide au sens de Brönsted.
Un acide est une espèce, ion ou molécule, susceptible de céder un proton H+.
L’acide salicylique étant un acide faible, écrire l'équation de sa
réaction avec l'eau.
AH aq + H2O(l) = H3O+aq +A-aq.
Après avoir fait l’inventaire des différentes espèces présentes en
solution, calculer leur concentration molaire.
AH aq, H2O(l), H3O+aq, A-aq, HO-aq minoritaire en milieu acide.
[H3O+aq]= 10-pH =10-2,6 =2,5 10-3 mol/L.
[HO-aq] = 10-14 / [H3O+aq] =10-14 / (2,5 10-3)= 4,0 10-12 mol/L.
La solution est électriquement neutre : [A-aq] = [H3O+aq]= 2,5 10-3 mol/L.
Conservation de A : [AHaq] + [A-aq] = C ; [AHaq] = 0,010-2,5 10-3 =7,5 10-3 mol/L.
Donner l’expression de la constante d’acidité Ka de la réaction et
calculer sa valeur.
Ka = [A-aq]éq [H3O+aq]éq / [AHaq]éq =(2,5 10-3)2 / (7,5 10-3)=8,3 10-4.
En déduire le pKa du couple acide salicylique/ion salicylate et le
comparer avec la valeur trouvée dans les tables de données qui est de 3,1.
pKa = - log Ka = -log(8,3 10-4) =3,1, en accord avec la valeur donnée dans les tables.
|
.
.
Dosage de l'acide salicylique dans une solution pharmaceutique.
On
achète en pharmacie un traitement contre les verrues. L’étiquette
indique : 10 g d'acide salicylique pour 100 mL de solution. On admet
que l'acide salicylique est la seule espèce chimique acide dans la
solution pharmaceutique. On désire vérifier par un titrage acidobasique
la composition en acide salicylique de la solution pharmaceutique. Pour
cela, on dilue 10 fois la solution pharmaceutique puis, on
prélève un volume Va = 20,0 mL de cette solution diluée que l'on dose par une solution aqueuse d'hydroxyde de sodium (Na+(aq) + HO-(aq)) de concentration molaire Cb = 0,100 mol/L.
On
relève le pH du mélange réactionnel après chaque ajout de solution
aqueuse d'hydroxyde de sodium, ce qui permet d’obtenir les résultats
suivants :
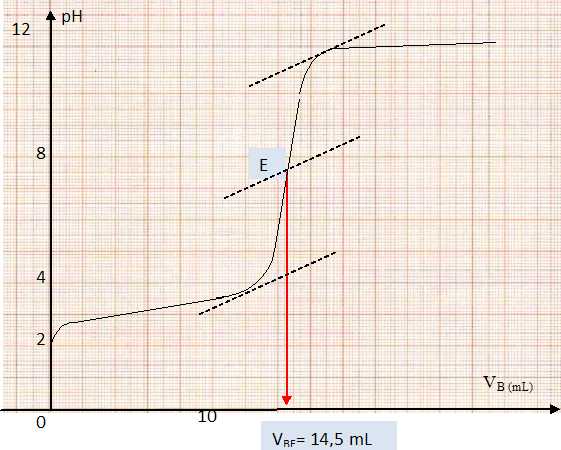
| Vb(mL) |
0 | 1,0 | 2,0 | 3,0 | 4,0 | 5,0 | 6,0 | 7,0 | 8,0 | 9,0 | 10,0 | 11 | 12 | 12,5 | 13 |
| pH |
2,1 | 2,2 | 2,3 | 2,4 | 2,5 | 2,6 | 2,7 | 2,9 | 3,2 | 3,3 | 3,5 | 3,8 | 4,0 | 4,2 | 4,4 |
| Vb(mL) |
13,5 | 14 | 14,5 | 14,8 | 15 | 15,5 | 16 | 17 | 18 | 19 | 20 | | | | |
| pH |
4,6 | 4,9 | 8,0 | 11 | 11,3 | 11,4 | 11,6 | 11,7 | 11,8 | 11,8 | 11,9 | | | | |
|
Ecrire l’équation chimique de la réaction de titrage. On supposera que la réaction est quantitative.
AHaq + HO-aq ---> A-aq + H2O(l).
Tracer la courbe donnant le pH en fonction du volume de base versé : pH = f (Vb). Déterminer le volume à l’équivalence.
Vérification de l’indication portée sur l’étiquette.
Après
avoir donné la définition de l'équivalence d’un titrage, écrire la
relation entre la quantité de matière d'acide salicylique AH(aq) et la
quantité de matière
d'ions hydroxyde HO- (aq), qui permet d'atteindre cette équivalence.
A
l'équivalence, les quantités de matière des réactifs sont en proportios
stoechiométriques. Avant l'équivalence, l'un des réactifs est en excès,
après l'équivalence, l'autre réactif est en excès.
n(AH) = n(HO-) ; Ca Va = Cb VBE
Calculer la concentration molaire en acide salicylique de la solution diluée puis de la solution pharmaceutique.
Ca = Cb VBE / Va= 0,100 *14,5 / 20,0 =7,25 10-2 mol/L.
En déduire la concentration massique en acide salicylique de la solution pharmaceutique.
Masse molaire de l'acide salicylique : M (AH) = 138 g/mol.
En tenant compte de la dilution au dixième, la concentration de la solution pharmaceutique est : C =0,725 mol/L.
Titre masique : C M(AH) = 0,725*138 =1,00 102 g/L.
Ce résultat est-il cohérent avec l’indication portée sur l’étiquette ?
"10 g d'acide salicylique pour 100 mL de solution" soit 100 g/L. Le rsultat est cohérent avec l'indication de l'étiquette.
-
|
|