.
|
|
Acide
gras
|
Formule
semi-développée
|
Formule
simplifiée
|
acide
a-linolénique
|
CH3-CH2(CH=CH-CH2)3-(CH2)6-COOH
|
C17H29-COOH
|
acide
linoléique
|
CH3-(CH2)4-(CH=CH-CH2)2-(CH2)6-COOH |
C17H31-COOH |
acide
oléique
|
CH3-(CH2)7-CH=CH-(CH2)7-COOH |
C17H33-COOH |
acide
stéarique
|
CH3-(CH2)16-COOH |
C17H35-COOH |
L'huile de lin.
L'huile de lin est constituée en majeure
partie d'un mélange de triglycérides issus des acides gras suivants :
l'acide a-linolénique ( 45 à
70 %), l'acide linoléique ( 12 à 24 %), l'acide oléique ( 10 à 21 %),
quelques acides gras saturés comme l'acide stéarique.
L'acide stéarique est un acide gras saturé alors
que l'acide a-linolénique,
l'acide linoléique et l'acide oléique sont des acides gras insaturés.
Quelle est la
caractérstique commune de ces molécules justifiant le qualificatif "
insaturé" ?
L'acide a-linolénique,
l'acide linoléique et l'acide oléique possèdent une ou plusieurs
liaisons doubles carbone-carbone.
Les triglycérides présents
dans la nature peuvent être synthétisés par réaction entre le glycérol
et des acides gras de formule générale R-COOH.
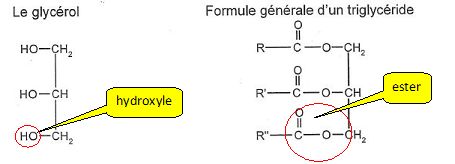
A
quelle famille de composés organiques appartient le glycérol ? Justifier.
Le glycérol possède trois groupes hydroxyle -OH liés à des atomes de
carbone tétragonaux ; le glycérol est un alcool ( tri-alcool).
A quelle famille de
composés organiques appartient un triglycéride ? Justifier.
Un triglycéride possède trois groupes ester. ( triester du glycérol ).
|
.
Fabrication du
savon noir.
Le savon
noir est un savon mou de couleur naturellement ambrée sombre, résultant
de la saponification de l'huile de lin par la potasse ( hydroxyde de
potassium K+aq + HO-aq). Dans cette partie on
considèrera que l'huile de lin est constituée uniquement du
triglycéride issu de l'acide a-linolénique,
que l'on appelera composé T.
Masse molaire du composé T : MT =872 g/mol ; masse molaire
du savon : MS = 316 g/mol ;
Formule du triglycéride T :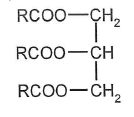
Quelle
est la formule brute du groupe R dans T ?
C17H29-
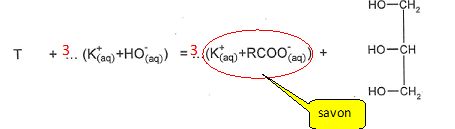
Compléter l'équation
de la réaction de saponification du composé T par la potasse et
encadrer le produit correspondant au savon.
On réalise cette synthèse à partir de m = 20 g d'huile de lin et V = 20
mL de solution de potasse à C = 5,0 mol/L. On porte ce mélange à
ébullition, additionné de 20 mL d'éthanol et de quelques grains de
pierre ponce, pendant 30 minutes.
Quel
dispositif utilisera t-on pour réaliser cette synthèse ? Expliquer
l'intérêt de ce dispositif.
Un chauffage à reflux permet d'accélérer la réaction en travailant à
température modérée tout en évitant les pertes de matière : les vapeurs
se condensent dans le réfrigérant à eau et retombent dans le milieu
réactionnel.
Déterminer
les quantités de matière initiales des réactifs.
n(T )= m / MT = 20 / 872 =2,2936 10-2 ~2,3 10-2
mol.
n(potasse) = C V =5,0 *0,020 =0,10 mol.
Compléter
le tableau d'évolution. La transformation étant totale, déterminer la
quantité de matière de savon synthétisé.
état
|
avancement
(mol)
|
T
|
+3
potasse
|
= 3
savon
|
+glycérol
|
initial
|
0
|
0,023
|
0,10
|
0
|
0
|
en
cours
|
x
|
0,023-x
|
0,10-3x
|
3x
|
x
|
final
|
xmax
|
0,023-xmax |
0,10-3xmax |
3xmax |
xmax |
Si T est en défaut : 0,023-xmax=0, xmax=0,023 mol.
Si la potasse est en défaut : 0,10-3xmax=0, xmax=0,033
mol.
On retient la plus petite valeur : xmax=0,023 mol.
n(savon) = 3 xmax=3*2,2936 10-2
= 6,881 10-2~ 6,9 10-2 mol.
Calculer
la masse de savon synthétisé.
n(savon) MS = 6,881 10-2*316=21,7
~22 g.
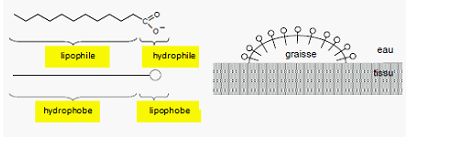
Action du savon.
Les propriétésdétergentes du savon, c'est à dire son aptitude à enlever
les sallisures, sont dues à la structure particulière de l'ion
carboxylate RCOO-. Sa tête polaire constituée du groupe -COO-
et sa longue chaîne carbonée R ont des propriétés antagonistes.
Nommer
les propriétés des deux parties de cet ion.
-COO- : hydrophile,
lipophobe ; R = lipophile, hydrophobe.
En utilisant la
représentation symbolique suivante, dessiner quelques ions carboxylate
du savon au niveau de l'interface entre la salissure graisseuse et l'eau.
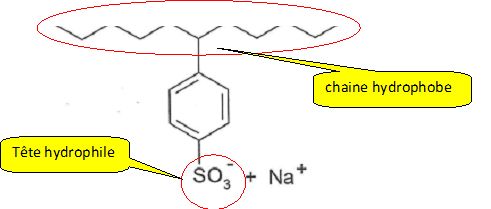
La formule du LAS est la suivante ; Montrer que l'anion
associé au cation na+ possède une action détergente, du fait de sa
structure analogue à celle de l'anion carboxylate du savon.
|
|
|




