Les
solutions aqueuses d'ammoniac sont obtenues par dissolution du gaz
ammoniac dans l'eau. L'ammoniac dissous NH3aq
est l'espèce basique du couple ion ammonium / ammoniac.
|
|
Ecrire
l'équation de la réaction de l'ion ammonium avec l'eau et donner
l'expression de la constante d'acidiité du couple ion
ammonium / ammoniac.
NH4+aq +H2O(l)
=NH3aq
+H3O+aq. Ka
= [H3O+aq][NH3aq]
/ [NH4+aq].
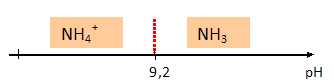
Etablir le
diagramme de prédominance relatif au couple ion ammonium / ammoniac et
donner l'espèce prédominante dans la solution étudiée dont
le pH est 10,2.
pKa( NH4+aq
/ NH3aq) = 9,2 ; à pH
supérieur à pKa, la forme base NH3aq prédomine.
On décide de titrer un volume VB=10,0 mL de
solution aqueuse d'ammoniac de concentration CB
= 0,100 mol/L.
On utilise une burette de 25 mL et on dispose de plusieurs flacons
d'acide chlorhydrique H3O+aq
+Cl-aq dont les concentrations sont : C1
=1,00 10-2 mol/L ; C2 =1,00 10-1
mol/L ; C3
=1,00 mol/L.
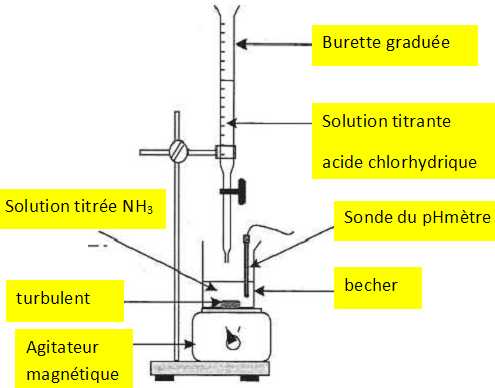
Légender
le dispositif de titrage.
Donner
l'équation de la réaction support du titrage.
NH3aq +H3O+aq =NH4+aq
+H2O(l).
|
Déterminer le volume de la chute Va
de burette pour atteindre l'équivalence pour chacune des
trois solutions d'acide chlorhydrique.
A l'équivalence Va Cacide
= CB VB ; Va = CB
VB / Cacide.
Va
1= CB VB
/ C1 = 0,100*10,0 / 1,00 10-2= 100 mL ; Va 2=
CB VB / C2 = 0,100*10,0 / 1,00 10-1= 10,0 mL ;
Va
3= CB VB
/ C3 = 0,100*10,0 / 1,00 = 1,00 mL.
En déduire
la solution du laboratoire la mieux adaptée à ce titrage.
(1) ne convient pas, il faudrait remplir plusieuurs fois la burette ;
(3) : le volume d'acide est trop petit, imprécision sur le volume VA
; (2) convient.
On
donne la courbe obtenue lors de ce titrage.
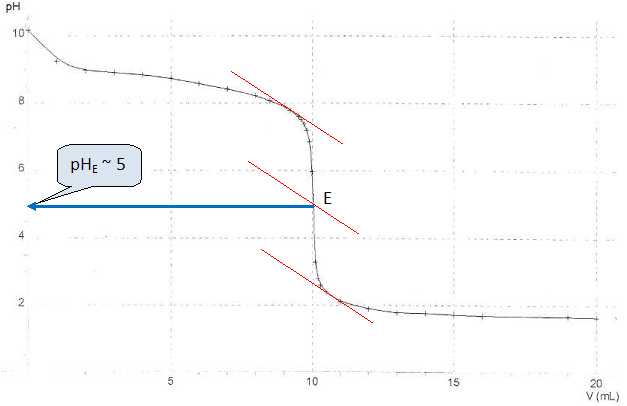
Quel
indicateur coloré convient le mieux ? Indiquer la variation de couleur
observée.
|
couleur
forme acide |
zone de virage |
couleur
forme base |
| carmin
indigo |
bleu |
11,6 - 14,0 |
jaune |
| thymolphtaléine |
incolore |
9,3 - 10,5 |
bleu |
| bleu
de bromothymol |
jaune |
6,0 - 7,6 |
bleu |
| vert
de bromocrésol |
jaune |
3,8 - 5,4 |
bleu |
La zone de virage de
l'indicateur coloré doit contenir le pH du point équivalent : le vert
de bromocrésol convient.
La couleur passe
du bleu au jaune.
Quand
le bleu apparaît.
Dans une fiole jaugée de volume V = 100,0 mL, un chimiste réalise le
mélange suivant :
VM =20,0 mL d'une solution de molybdate
d'ammonium de concentration CM =4,0 10-2
mol/L ; 10 mL d'acide sulfurique à 4,5 mol/L ; VF
= 20,0 mL d'une solution de fructose de concentration CF
=2,0 10-4 mol/L.
Le mélange est complété à 100,0 mL avec de l'eau distillée.
La solution S obtenue, initialement incolore, est répartie dans des
tubes à essai placés dans un bain-marie. Une coloration bleue de plus
en plus intense apparaît peu à peu dans chaque tube. Les tubes sont
sortis du bain-marie les uns après les autres à différents instants et
plongés dans de l'eau glacée pendant quelques minutes. L'absorbance de
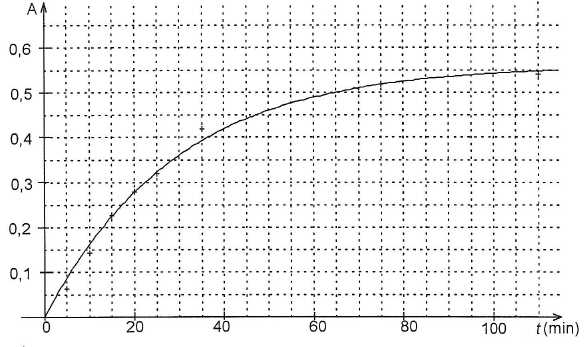
la solution S à ces différents instants est mesurée à une longueur
d'onde de 720 nm. La mesure de l'absorbance en fonction du temps est
donnée. L'absorbance A est reliée à la concentration C de l'espèce
colorée par la relation : A = k C où k est une constante.
Lors de cette réaction, le fructose (F) est oxydé en un produit (F')
incolore. Le molybdate d'ammonium noté Mo(ox) est réduit en Mo(red).
L'équation de la réaction peut s'écrire :
F + Mo(ox) = F' + Mo(red) (1).
Déterminer
l'espèce responsable de la couleur bleu.
Fructose, Mo(ox), F' sont incolores ; Mo(red) est responsable de la
couleur bleue.
L'allure
de la courbe est-elle en cohérence avec l'observation expérimentale ?
Interpréter.
" Une coloration bleue de plus en plus intense apparaît peu à peu " :
la concentration en Mo(red) augmente ; l'absorbance est proportionnelle
à la concentration de l'espèce colorée : A augmente avec le
temps.
En
déduire l'expression de la concentration [Mo(red)] en fonction de
l'absorbance A mesurée.
A = k [Mo(red)] ; [Mo(red)] = A / k
On
donne l'expression de la vitesse volumique de la réaction :v = 1/V
dx/dt.
Compléter
le tableau d'évolution de la transformation (1).
| état |
avancement
(mol) |
F |
+Mo(ox) |
=F' |
+Mo(red) |
| initial |
0 |
VFCF
=0,020*2,0 10-4
=4,0 10-6. |
VMCM
=0,020*4,0 10-4
=8,0 10-6. |
0 |
0 |
| en
cours |
x |
VFCF
-x = 4,0 10-6-x |
VMCM -x
= 8,0 10-6-x |
x |
x |
| fin |
xf |
4,0 10-6-xf |
8,0 10-6-xf |
xf |
xf |
Montrer
que l'absorbance est proportionnelle à l'avancement à tout instant.
[Mo(red) ]= x / V ; A = k [Mo(red) ] = k/V x avec V
constant.
Montrer
que la vitesse volumique de la réaction peut s'écrire : v = 1/k dA/dt.
v = 1/V dx/dt avec x = A V/k ; dx/dt = V/k dA/dt d'où : v = 1/k dA/dt.
Tracer
l'allure de l'évolution de la vitesse volumique au cours du temps.
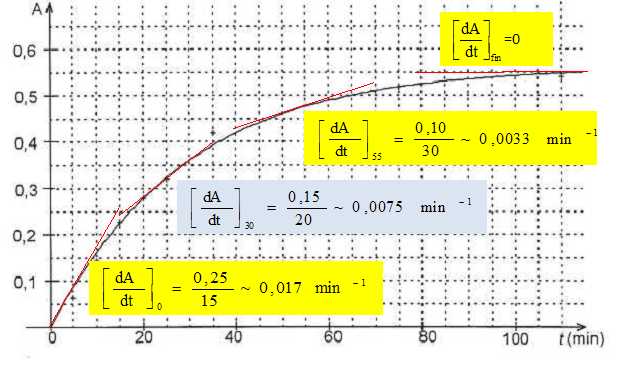
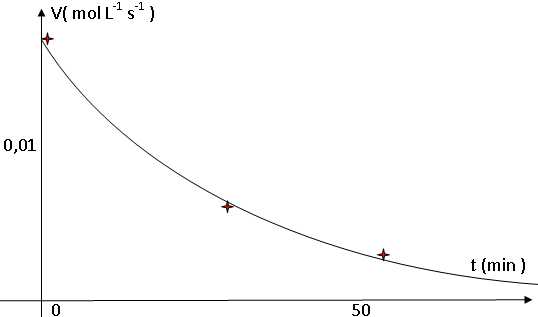
Indiquer
si la variation de l'intensité de la couleur est mieux détectée par le
chimiste pendant la première ou la deuxième heure de l'enregistrement.
Pendant la première heure, l'absorbance passe de zéro à 0,50 ; pendant
la deuxième heure, l'absorbance passe de 0,50 à 0,55.
L'absorbance est proportionnelle à la concentration de l'espèce colorée
: la variation de la couleur est grande durant la première
heure.
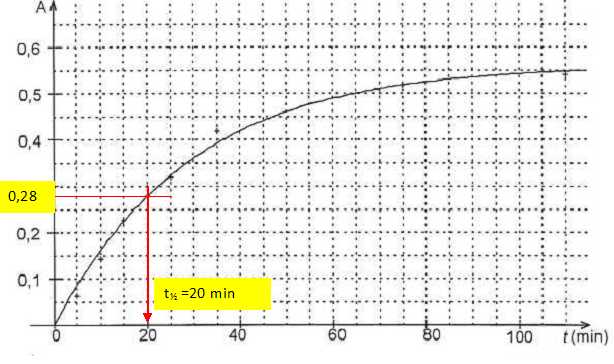
Au bout d'une durée suffisamment longue, l'ansorbance atteint sa valeur
finale Afin = 0,56.
Déterminer
la valeur du temps de demi-réaction. Justifier.
L'absorbance étant proportionnelle à l'avancement et l'avancement au
temps de demi-réaction étant égal à la moitié de l'avancement final, on
recherche l'abscisse correspondant à l'absorbance ½ Afin =
0,28.
Pendant les cinq premières minutes, le chimiste s'inquiète car il ne
voit aucune apparition de la couleur prévue.
Proposer
une modification du protocole permettant une diminution de la valeur du
temps de demi-réaction.
Travailler à une température un peu plus élevée.
|
|
|






