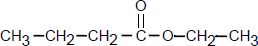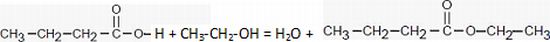L'ananas
est sans doute le plus emblématique des fruits tropicaux. Son parfum
unique et sa couronne verdoyante lui ont valu, dans bien des pays, le
surnom de « roi des fruits ».
L'arôme très attrayant de l'ananas a été l'objet de beaucoup de travaux
d'analyse : plus de 280 substances aromatiques ont été identifiées.
Tenter de recréer l’odeur et la saveur si subtiles de l’ananas demeure
un défi de taille pour le chimiste.
L’arôme artificiel d’ananas est obtenu industriellement en mélangeant
sept esters, trois acides carboxyliques et sept huiles essentielles.
Les trois composés majoritaires de ce mélange sont le butanoate
d’éthyle (22%),
l’éthanoate d’éthyle (15%) et l’acide butanoïque (12%). D’après
orkos.com et Introduction to Organic Laboratory Techniques, A
Contemporary Approach de Donald L. Pavia
|
|
L’objectif
de cet exercice est d’étudier d’une part la préparation de l’acide
butanoïque à partir du beurre et d’autre part la réaction de synthèse
du butanoate d’éthyle. L’acide butanoïque et le butanoate d’éthyle sont
deux espèces chimiques présentes dans l’ananas.
Préparation de l’acide butanoïque à partir du beurre.
L’acide butanoïque peut être préparé à partir de la butyrine que l’on trouve dans le beurre.
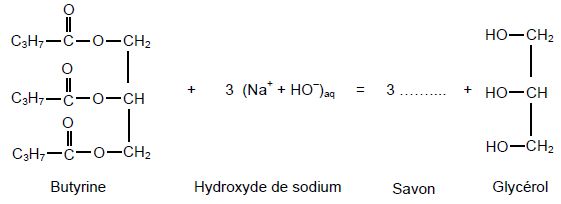
Étape 1 : la butyrine réagit à chaud avec une solution aqueuse concentrée d’hydroxyde de sodium (Na+ + HO-)aq.
Après refroidissement et autres traitements, on obtient du savon.
Étape 2 : on dissout le savon obtenu précédemment dans de l’eau chaude et on le fait réagir avec une solution d’acide chlorhydrique (H3O+ + Cl -)aq. On obtient de l’acide butanoïque.
Données :
La butyrine est un corps gras de formule semi-développée :
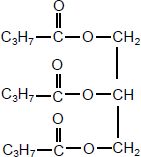
l’équation de la réaction chimique entre la butyrine et la solution d’hydroxyde de sodium est :
Comment s’appelle la réaction chimique qui consiste à faire réagir la butyrine avec la solution
d’hydroxyde de sodium ?
Hydrolyse basique ou saponification d'un ester.
Donner la formule du savon obtenu et identifier sa partie hydrophobe.
C3H7-COO- + Na+. La partie hydrophobe est la chaîne carbonée C3H7-.
Lors de l’étape 2, une réaction acido-basique mettant en jeu l’ion butanoate C3H7-COO- se produit.
Écrire l’équation de cette réaction chimique.
C3H7-COO- aq +H3O+aq = C3H7-COOH aq + H2O(l)
Exprimer la constante d’équilibre de cette réaction. Calculer sa valeur à 25°C.
C3H7-COOH / C3H7-COO- pKa= 4,8.
K = [C3H7-COOH] / ([C3H7-COO-][H3O+]) =1 / Ka = 104,8= 1,6 10-5.
|
.
Synthèse du butanoate d’éthyle.
Le butanoate d’éthyle a pour formule semi-développée :
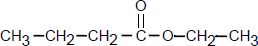
Il est synthétisé en faisant réagir l'acide butanoïque (A) et un alcool (B).
À quelle famille de composés organiques appartient le butanoate d’éthyle ? Ester.
Écrire l’équation de la réaction chimique de synthèse du butanoate d’éthyle en utilisant les formules semi-développées.
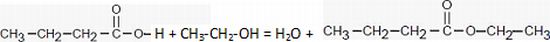
Donner le nom de l'alcool (B). Ethanol ou alcool éthylique.
Rappeler les caractéristiques de cette transformation chimique.
Lente, pratiquement athermique, limitée par l'hydrolyse de l'ester.
Synthèse au laboratoire.
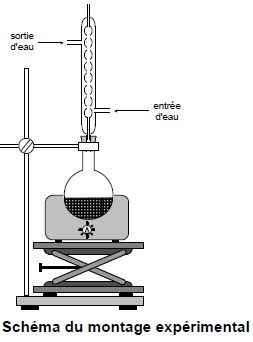
Dans un ballon, on mélange une quantité de matière nA = 0,22 mol d’acide butanoïque (A) avec un volume VB = 12,8 mL d’alcool (B). On ajoute environ 1 mL d’une solution concentrée d’acide sulfurique et
quelques grains de pierre ponce. On réalise le montage ci-dessous et on chauffe à ébullition pendant 30 minutes.
On refroidit ensuite le ballon sous le robinet d’eau froide, puis on
verse son contenu dans un récipient contenant de l’eau salée. On
observe deux phases liquides que l’on sépare à l’aide d’une ampoule à
décanter. La phase organique est alors lavée et séchée. On obtient une masse mE = 14,8 g de butanoate d’éthyle (E).
Nom
|
Masse molaire ( g/mol)
|
Masse volumique ( g/mL)
|
acide butanoïque (A)
|
MA=88
|
rA =0,96
|
alcool (B)
|
MB=46 |
rB =0,79 |
butanoate d'éthyle (E)
|
ME=116 |
rE =0,88 |
Comment nomme-t-on le montage ci-dessus ? Chauffage à reflux.
L’acide sulfurique concentré ajouté dans le mélange réactionnel sert de catalyseur.
Quel est le rôle d’un catalyseur ?
Le catalyseur augmente la vitesse de la réaction sans modifier la composition du mélange à l'équilibre.
Donner l’expression littérale de la quantité de matière nB d’alcool introduite dans le ballon.
masse : m = VB rB ; nB = m/MB = VB rB /MB.
Le mélange d’acide butanoïque (A) et d’alcool (B) est équimolaire. Calculer le rendement de la synthèse.
rendement = nE réelle / nE théorique max ; nE réelle = mE / ME = 14,8 / 116 = 0,128 mol ; nE théorique max = nA = 0,22 mol.
Rendement = 0,128/0,22 ~0,58 ( 58 %).
On souhaite augmenter la quantité maximale de butanoate d’éthyle produit. Plusieurs propositions sont envisagées :
Proposition 1 : ajouter l’alcool (B) en excès au 0,22 mol d’acide butanoïque ;
Proposition 2 : doubler le volume d’acide sulfurique ;
Proposition 3 : remplacer l’acide butanoïque par l’anhydride correspondant.
Quelle(s) est (sont) celle(s) qui le permet(tent) (aucune justification n’est demandée) ?
Propositions 1 et 3.
|
|