.
|
|
l'aluminium présente, à l'état naturel, une couche superficielle d'alumine Al2O3
qui le protège de l'oxydation. Cette couche naturelle, de
quelques nanomètres d'épaisseur, est sujette à la détérioration. Une
meilleure protection de l'aluminium contre la corrosion est obtenue en
accroissant l'épaisseur de la couche d'alumine. Cette technique appelée
anodisation consiste en une électrolyse en milieu acide.
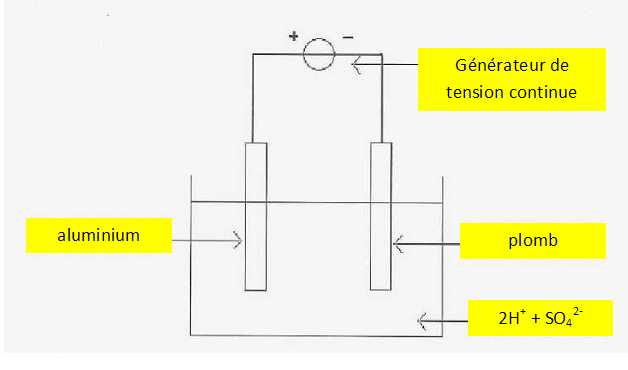
Dans une cuve contenant une solution d'acide sulfurique 2H+ + SO42-
la pièce d'aluminium est reliée à la borne positive d'un générateur de
courant continu ; la borne négative du générateur est reliée à une
électrode en plomb.
On peut colorer les pièces en aluminium au cours
du processus : la coloration s'effectue par absorption dans les pores
de la couche d'alumine d'un colorant. Le colmatage est la technique
permettant l'obturation ou la fermeture des pores existants dans la
couche d'oxyde. Cette opération est réalisée en immergeant les pièces
anodisées dans de l'eau en ébullition pour favoriser la cinétique de la
réaction.
Une couche d'alumine naturelle.
Une
couche d'alumine se forme rapidement à chaud quand on expose
l'aluminium à l'air. l'alumine se forme spontanément très rapidement
quand l'aluminium est mis en contact avec un milieu oxydant comme
l'oxygène de l'air.
Ecrire l'équation de la transformation chimique citée ci-dessus.
4Al(s) + 3O2(g) = 2Al2O3(s).
Quel réactif, de cette transformation chimique, limite la formation de la couche d'alumine ?
Le dioxygène de l'air est en large excès ; l'aluminium, rapidement recouvert d'alumine protectrice, est en défaut.
Augmentation de la couche d'alumine par anodisation dure.
Compléter le schéma en utilisant les termes utilisés dans le texte de l'introduction.
Il se produit un dégagement gazeux de dihydrogène sur l'une des électrodes.
Ecrire
la demi-équation électronique correspondante. S'agit-il d'une oxydation
ou d'une réduction ? Quel est le nom de l'électrode où se produit ce
dégagement ?
La réduction de l'ion H+ a lieu à la cathode négative : 2H+aq +
2e- = H2(g).
Sur l'autre électrode,il se produit la réaction suivante : Al(s) = 3e- +Al3+aq.
Ensuite les ions aluminium réagissent selon la réaction : 2Al3+aq + 3H2O(l) = Al2O3(s) + 6H+aq.
Montrer que l'équation globale de la réaction est : 2Al(s) + 3H2O(l) = Al2O3(s) + 3H2(g).
6H+aq + 6e- = 3 H2(g). (1)
2Al(s) = 6e- + 2Al3+aq. (2)
2Al3+aq + 3H2O(l) = Al2O3(s) + 6H+aq (3).
Ajouter (1) +(2) +(3) :
6H+aq + 6e- +2Al(s) +2Al3+aq + 3H2O(l) = 3 H2(g) + 6e- + 2Al3+aq +Al2O3(s) + 6H+aq.
Simplifier : 2Al(s) + 3H2O(l) = 3 H2(g) +Al2O3(s).
|
.
.
Exprimer la quantité d'électricité Q en fonction de l'intensité du courant I et de la durée Dt.
Q = I Dt.
Exprimer la quantité d'électricité en fonction de la quantité de matière d'électrons.
Q =n(e-)
NA e.
Montrer que Q =3n(Al)
NA e. En déduire que Dt = 3mAl NA e / (I M(Al)).
D'après les nombres stoechiométriques de : Al(s) = 3e- +Al3+aq.
n(e-) = 3n(Al) ; d'où : Q = 3n(Al)
NA e.
or n(Al) = mAl / M(Al) ; donc : Q = 3mAl / M(Al)
NA e.
Q = 3mAl / M(Al)
NA e= I Dt ; par suite Dt = 3mAl NA e / (I M(Al)).
On
souhaite colorer une clé ( de serrure de porte ) en aluminium en y
déposant une couche d'alumine d'épaisseur h = 100 µm. Le volume
d'alumine à déposer est V = 0,17 mL.
On donne la masse volumique de l'alumine r = 3,0 g/mL.
Calculer la masse d'alumine à déposer.
mAl = V r = 0,17 * 3,0 = 0,51 g.
D'après le texte introductif, dire quel est le facteur cinétique mis en jeu au cours de la dernière étape.
"Cette opération est réalisée en immergeant
les pièces anodisées dans de l'eau en ébullition pour favoriser la
cinétique de la réaction"
La température est un facteur cinétique.
|
|
|