L'étamage consiste à recouvrir un solide d'une mince
couche d'étain métallique Sn(s) par électrolyse.
|
|
Constante
d'équilibre associée à l'équation d'oxydoréduction entre l'étain Sn(s)
et les ions argent Ag+aq : K =6,3 1080.
M(Ag) = 108 ; M(Sn) = 118,7 g/mol ; M(SnCl2,2H2O)
=225,7 g/mol.
F = 9,65 104 C mol-1 ; µSn = 7,29 103
kg m-3 ;
aire latérale d'un cylindre de rayon r et de longueur L : S = 2 p r L.
On dispose du matériel suivant : éprouvettes graduées de 100 mL, 250 mL
; divers béchers ; fioles jaugées de 50,0 mL, 100,0 mL, 250,0 mL et
500,0 mL ; burette de 25,0 mL et pipettes graduées et jaugées de 5,0
mL, 10,0 mL et 20,0 mL ; balance de précision, coupelle de pesée,
spatule, eau distillée.
Préparation
des solutions.
On veut préparer un volume V1 = 500,0 mL d'une solution
aqueuse S1 de chlorure d'étain à partir du produit commercial, solide
ionique dihydraté SnCl2, 2H2O ; dans cette
solution, les ions Sn2+aq doivent avoir une concentration
molaire effective c1 = 0,100 mol/L.
Calculer
la masse du solide ms à peser et décrire le protocole à
suivre.
Concentration en soluté apporté : c1 ; quantité de matière
de soluté : n = c1 V1 = 0,100 *0,500 = 0,0500 mol.
ms = n M(SnCl2,2H2O)
=0,0500*225,7 =11,285 ~11,3 g.
Mettre une coupelle sur la balance et appuyer sur "tare" ; à l'aide
d'une spatule prélever le solide et effectuer la pesée.
Placer un entonnoir sur la fiole jaugée de 500,0 mL et y verser le
solide ; rincer entonnoir et coupelle à l'eau distillée ; remplir à
moitié la fiole jaugée avec de l'eau distillée ; agiter pour dissoudre
le solide puis compléter la fiole avec de l'eau distillée jusqu'au
trait de jauge. Boucher, agiter pour rendre homogène.
On dispose d'une solution de nitrate d'argent Ag+aq + NO3-aq
de concentration molaire c = 1,00 mol/L. A partir de celle-ci on
souhaite préparer un volume V2 = 100,0 mL de solution S2
de concentration c2 = 0,100 mol/L.
Décrire le protocole.
Le facteur de dilution, rapport des concentrations, est égal à 10.
Prélever 10,0 mL de la solution mère à l'aide d'une pipette jaugée et
placer le prélevement dans une fiole jaugée de 100,0 mL. Compléter avec
de l'eau distillée jusqu'au trait de jauge. Boucher, agiter pour rendre
homogène.
Etude d'une
pile étain argent.
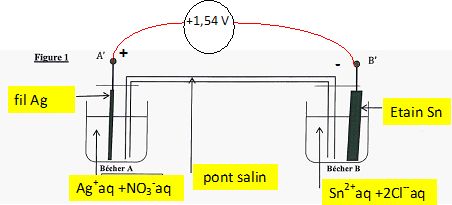
On réalise deux demi-piles A et B constituées :
- pour A : d'un bécher contenant un fil d'argent (Ag) plongeant dans
environ 80 mL de la solution S2 ;
- pour B : d'un becher contenant une plaque d'étain Sn plongeant dans
environ 80 mL de la solution S1.
Les deux demi-piles sont reliées par un pont salin contenant une
solution gélifiée de nitrate de potassium K+aq + NO3-aq.
On branche un voltmètre aux bornes de la pile de manière à mesurer la
tension UA'B'. Le résultat obtenu est UA'B'
= +1,54 V.
Légender
le schéma de la pile. Quelle est la borne positive ? Quelle est sa fem
E ?
La fem E est la tension mesurée à vide : E = +1,54 V.
|
.
On branche la pile sur un conducteur ohmique de résistance R.
Indiquer
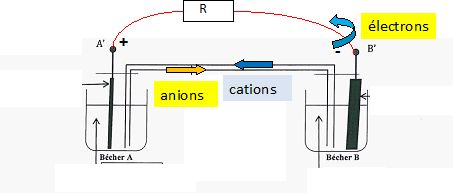
quelle est la nature des charges qui circulet à l'itérieur de la pile
et à l'extérieur quand elle débite un courant. Préciser le sens de
circulation de chaque catégorie de charge.
Les électrons circulent dans les parties métalliques et le conducteur ohmique ; les ions se déplacent à l'intérieur de la pile.
Fonctionnement de la pile.
Ecrire les demi-équations chimiques des transformations qui ont lieu sur chaque électrode.
Oxydation de l'étain à l'anode négative : Sn(s) = Sn2+aq + 2e-.
Réduction des ions argent à la cathode positive : 2Ag+aq + 2e- = 2Ag(s).
Ecrire l'équation chimique correspondant au bilan du fonctionnement de la pile.
Sn(s) + 2Ag+aq= Sn2+aq + 2Ag(s).
Exprimer puis calculer le quotient initial Qr i.
Qr i = [Sn2+aq]i / [Ag+aq]i2 = 0,100 / 0,100 2 =10.
Le système va-t-il évoluer au cours du temps ? Si oui, dans quel sens ?
Qr i < K, le système évolue spontanément dans le sens direct.
Après un fonctionnement de 60 min, la masse de l'une des deux électrodes diminue de 178 mg.
De quelle électrode s'agit-il ? Justifier.
Oxydation de l'étain à l'anode négative : Sn(s) = Sn2+aq + 2e-.
Quelle est la variation de masse de l'autre électrode ?
Quantité de matière d'étain oxydé : n (Sn)= 0,178 / 118,7 =1,50 10-3 mol.
Sn(s) + 2Ag+aq= Sn2+aq + 2Ag(s).
D'après les nombres stoechiométriques de cette équation: n(Ag) = 2 n(Sn) = 3,00 10-3 mol.
La masse d'électrode d'argent augmente de : 3,00 10-3 *108 = 0,324 g = 324 mg.
Quelle est l'intensité constante du courant électrique qui a permis ce dépôt ?
Ag+aq + e- = Ag(s).
Quantité de matière d'électrons : n(e-) = n(Ag) = 3,00 10-3 mol.
Quantité d'électricité Q = It = n(e-) F ; I = n(e-) F / t = 3,00 10-3 *9,65 104 / (60*60) =0,0804 A ~ 80 mA.
Etamage du cuivre par électrolyse.
Il reste un volume V'1
= 400 mL de chlorure d'étain(II) préparée. On utilise cette solution
pour réaliser un dépôt d'étain de protection sur une bobine de fil de
cuivre. Le fil, de forme cylindrique, a un rayon r = 1,0 mm. On enroule
le fil en spires non jointives et on en plonge une longueur L =
2,0 m dans le bain de solution S1. On ajoute la plaque
d'étain dans le bain et on relie le fil de cuivre et la lame
d'étain aux bornes d'un générateur G. La tension aux bornes du
générateur est U = 6,0 V. Un ampèremètre permet de contrôler
l'intensité du courant électrique et une résistance réglable permet de
la maintenir constante et égale à I0 = 0,75 A.
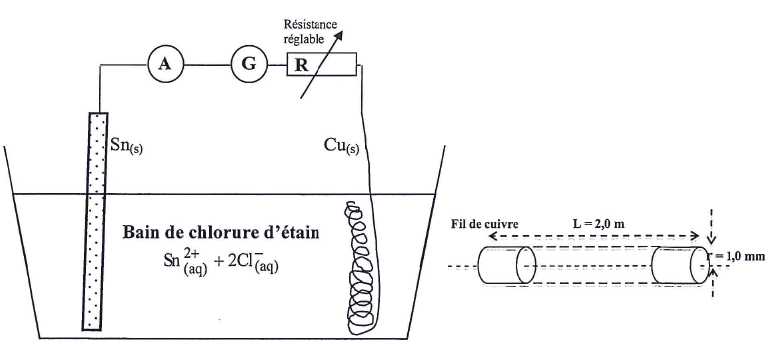
L'électrolyse est-elle une réaction spontanée ou forcée ? Justifier.
L'électrolyse est une réaction forcée ; elle nécessite un apport d'énergie sous forme électrique.
On veut réaliser un dépôt d'étain d'épaisseur e = 30 µm sur le fil de cuivre.
Montrer que l'expression littérale du volume d'étain à déposer sur le fil de cuivre est VSn = 2 p r L e.
Surface latérale du fil cylindrique de rayon r et de longueur L : S = 2 p r L.
Volume du dépôt d'étain : VSn = S e = 2 p r L e.
En déduire l'expression littérale de la masse mSn puis la quantité de matière d'étain à déposer. Calculer la quantité de matière d'étain nSn à déposer.
mSn = VSn rSn = 2 p r L e µSn.
nSn = mSn / M(Sn) = 2 p r L e µSn / M(Sn).
nSn = 2*3,14 *1,0 10-3 * 2,0 *30 10-6 *7,29 103 / 0,1187 = 2,315 10-2 ~2,3 10-2 mol.
Exprimer littéralement en fonction de nSn, la quantité d'électricité Q nécessaire pour réaliser ce dépôt et en déduire la durée Dt de l'électrolyse.
Sn2+aq + 2e-= Sn(s) ; n(e-) = 2 nSn.
Q = n(e-)F =I Dt ; Dt = n(e-)F / I = 2 nSnF / I = 2*2,315 10-2 *9,65 104 / 0,75 = 5,957 103 ~6,0 103 s.
|
|
|


