.
|
|
L'acide
salicylique, noté A dans l’exercice, est un intermédiaire de synthèse
intéressant car il possède deux groupes caractéristiques susceptibles
de réagir selon la nature du réactif mis en présence.
Le salicylate de méthyle (utilisé comme arôme alimentaire sous le nom
d’essence de Wintergreen) et l’acide acétylsalicylique (communément
appelé aspirine) peuvent tous deux être synthétisés à partir de l’acide
salicylique A par estérification suivant les équations de réaction 1 et
2.
Étude des molécules.
En prenant appui sur le texte et les équations 1 et 2 :
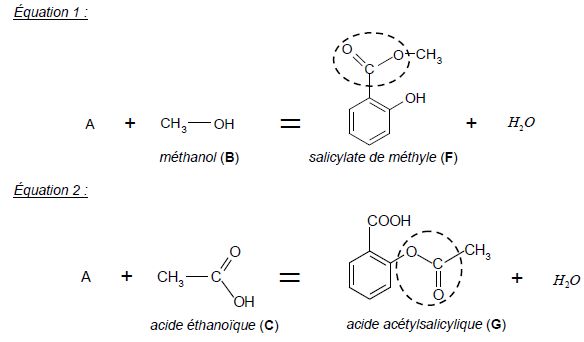
Nommer le groupe caractéristique entouré dans les molécules F et G.
Le groupe encadré est le groupe caractéristique des esters.
Identifier les groupes caractéristiques présents dans la molécule A. Justifier.
Un alcool, le méthanol B, conduit à un ester en réagissant avec un groupe carboxyle -COOH.
L'acide éthanoïque C conduit à un ester en réagissant avec le groupe hydroxyle -OH d'un alcool.
Écrire la formule semi-développée de l’acide salicylique A.
Synthèse du salicylate de méthyle (F) suivant la réaction d’équation 1.
Données :
|
masse volumique ( g cm-3 )
|
masse molaire ( g / mol)
|
acide salicylique A
|
|
138
|
méthanol B
|
0,79
|
32
|
salicylate de méthyle F
|
1,18
|
152
|
Résumé du protocole :
Dans un ballon, on introduit 1,50 g de A, environ 14 mL de B et quelques gouttes d’acide sulfurique concentré.
On réalise le montage dessiné ci-contre et le mélange est
porté à ébullition pendant plus d’une heure.
On laisse ensuite refroidir le mélange puis on traite le contenu du
ballon (extraction, lavage, séchage). À l’issue de ces opérations on
récupère 1,27 g de produit F. |
|
|
.
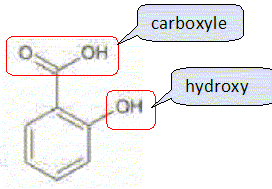
Nommer le montage et préciser son intérêt.
Le
chauffage à reflux permet d'accélérer la réaction tout en évitant les
pertes de matière. Les vapeurs se condensent dans le réfrigérant et
retombent dans le milieu réactionnel.
Montrer que le méthanol est utilisé en large excès.
masse de B = m(B) = volume ( mL) fois masse volumique de B( gmL) = 14 *0,79 = 11,06 g
n(B) = m(B) / M(B) = 11,06 / 32 = 0,3456 ~0,35 mol.
n(A) = m(A) / M(A) = 1,50 / 138 =1,087 10-2 ~1,09 10-2 mol.
1,09 10-2 mol de A réagit avec 1,09 10-2 mol de B : B est donc en excès.
Préciser l’intérêt de ce large excès.
L'équilibre est déplacé dans le sens direct ; il se forme davantage d'ester, le rendement augmente.
Quel est le rôle de l’acide sulfurique ?
L'acide sulfurique joue le rôle de catalyseur.
Calculer la masse maximale de salicylate de méthyle que l’on peut espérer obtenir dans l’hypothèse d’une transformation totale.
nmax(ester) = 1,087 10-2mol ; m = 1,087 10-2*152 =1,65 g.
En déduire le rendement expérimental r de la synthèse.
masse réelle / masse théorique maximale = 1,27 / 1,65 =0,769 ( 76,9 %).
Synthèse de l’acide acétylsalicylique (G) suivant la réaction d’équation 2.
Donnée : Constante d’équilibre K associée à l’équation 2 : K = 7,7 10-3.
On considère un mélange initial homogène constitué de 0,10 mol de A et 0,10 mol de C.
Exprimer puis calculer le quotient de réaction Q r i dans l’état initial.
Q r i =[G]i[eau]i / ([A]i[C]i = 0 x 0 / (0,10 x 0,10) = 0.
Justifier que le système chimique évolue spontanément dans le sens direct.
Q r i < K, le système évolue spontanément dans le sens direct.
Compléter le tableau descriptif de l’évolution du système.
|
avancement (mol)
|
A
|
+ C
|
= G
|
+eau
|
initial
|
0
|
0,10
|
0,10
|
0
|
0
|
en cours
|
x
|
0,10-x
|
0,10-x
|
x
|
x
|
équilibre
|
xéq
|
0,10-xéq |
0,10 -xéq |
xéq |
xéq |
On montre qu’à l’état d’équilibre l’avancement final xéq est lié à la constante d’équilibre K par la relation :
xéq = 0,10 K½ / (1+K½).
Calculer xéq et en déduire la valeur du taux d’avancement t de la réaction de synthèse.
xéq = 0,10 (7,7 10-3)½ / (1+(7,7 10-3)½) = 8,775 10-3 / 1,08775 =8,067 10-3 ~8,1 10-3 mol.
t = xéq / xmax = 8,067 10-3 / 0,10 =0,081 ( 8,1 %).
Quel autre réactif pourrait-on utiliser à la place de l’acide éthanoïque pour améliorer le rendement de cette synthèse ?
Il faut remplacer l'acide éthanoïque par l'anhydride éthanoïque.
|
|
|


