.
|
|
Les
solutions aqueuses considérées sont prises à 25°C.
Produit ionique de l’eau : Ke = 1,0.10-14.
Volume molaire dans les conditions de l’expérience : Vm =
24,0 L.mol-1.
Couples de l’eau : H3O+/ H2O et H2O
/HO-.
Couple acide éthanoïque / ion éthanoate : CH3COOH / CH3COO-;
Ka1 = 1,6.10- 5.
Couple ion ammonium / ammoniac : NH4+/ NH3
; Ka2 = 6,3.10- 10.
Zones de virage de quelques indicateurs colorés :
Indicateur
|
Hélianthine
|
Bleu
de bromothymol
|
Rouge
de Crésol
|
Phénolphtaléine
|
Zone
de virage
|
3,2
- 4,4
|
6,0
- 7,6
|
7,2
- 8,8
|
8,2
- 10
|
Cet
exercice comporte 9 affirmations numérotées de 1.1 à 3.3.
Répondre à chaque affirmation par VRAI ou FAUX. Toute réponse doit être
accompagnée de justifications ou de commentaires brefs (définitions,
calculs, justifications graphiques).
Solution d’acide
éthanoïque.
Le pH d’une solution aqueuse d’acide éthanoïque de concentration
molaire C = 1,0.10-2 mol.L-1est de 3,4.
L’équation de réaction entre l’acide éthanoïque et l’eau s’écrit :
CH3COOH aq + H2O(l) = CH3COO-
aq +H3O+aq. Vrai.
Les couples acide / base
intervenant sont : CH3COOH / CH3COO-; H3O+/ H2O.
L'acide CH3COOH
du premier couple échange un proton avec la base H2O du second couple.
Cette transformation est
limitée. Vrai.
xf
= 10-3,4 = 4,0 10-4
mol ; xmax = 1,0.10-2 mol. t =xf / xmax= 4,0 10-4 / 1,0.10-2 = 0,040.
t <1, la
transformation est limitée.
Le rapport
[CH3COO- aq]f / [CH3COOH
aq]f = 25. Faux.
pH = pKa1
+ log ([CH3COO- aq]f
/ [CH3COOH
aq]f) ; pKa1
=- log (1,6.10- 5) =4,8
log ([CH3COO- aq]f
/ [CH3COOH
aq]f) =3,4 -4,8 = -1,4 ; [CH3COO-
aq]f / [CH3COOH
aq]f
=0,04.
|
.
Réaction de l’ammoniac avec l’eau.
On dissout dans l’eau 50 mL d’ammoniac NH3 gazeux de manière à obtenir 200 mL de solution.
La réaction de l’ammoniac avec l’eau s’écrit :
NH3 (g)+ H2O(l) = NH4+aq +HO-aq.
La concentration molaire en ammoniac apporté est de 4,2.10-4 mol.L-1. Faux.
n (NH3 (g))= V / Vm = 0,050 / 24 = 2,083 10-3 mol ; c = 2,083 10-3 / 0,200 =1,0 10-2 mol/L.
L’ammoniac est un acide au sens de Brönsted. Faux.
L'ammoniac est susecptible de gagner un proton : c'est une base de Brönsted.
La constante d’équilibre K associée à la transformation vaut 1,6.10-5. Vrai.
K = [ NH4+aq]éq[HO-aq]éq / [NH3 (g)]éq or Ka2 = [NH3 (g)]éq[H3O+aq]éq /[ NH4+aq]éq.
K Ka2 =[HO-aq]éq[H3O+aq]éq = Ke ; K = Ke / Ka2 =1,0 10-14 / (6,3.10- 10) =1,6.10-5.
Dosage de l’acide méthanoïque par la soude.
On réalise la simulation du titrage pH-métrique d’un volume Va = 10,0 mL de solution aqueuse d’acide méthanoïque HCOOH de concentration molaire Ca = 1,5.10-2 mol.L-1 par une solution aqueuse d’hydroxyde de sodium de concentration molaire Cb = 1,0.10-2 mol.L-1.
L’équation de la réaction servant de support au titrage est :
HCOOH aq + HO-aq = HCOO-aq + H2O(l).
La courbe pH = f(Vb) ainsi que les variations des pourcentages des espèces du couple acide méthanoïque/ion méthanoate en fonction du volume Vb de solution d’hydroxyde de sodium versé sont représentées.
La courbe 2 est la courbe d’évolution du pourcentage d’acide méthanoïque. Vrai.
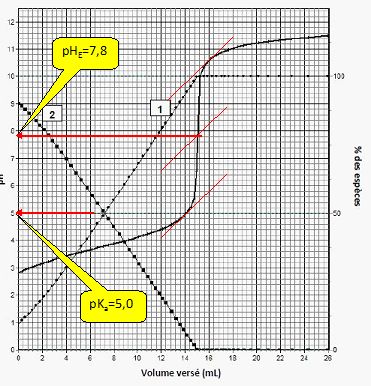
A l'équivalence, nous
avons une solution de méthanoate de sodium. L'ion méthanoate réagit
partiellement avec l'eau : le pourcentage d'ion méthanoate est proche
de 100 % alors que celui de l'acide méthanoïque est proche de zéro. Initialement à pH =2,8, valeur inférieur au pKa, l'acide méthanoïque est largement majoritaire.
Le pKa du couple HCOOH / HCOO- est égal à 5,0. Vrai.
A pH = pKa, [HCOOH]=[HCOO-]. Le graphe indique pKa = 5.
Le rouge de crésol peut être utilisé comme indicateur coloré de fin de réaction. Vrai.
La zone de virage du rouge de crésol contient le pH du point équivalent.
|
|
|
