En
solution aqueuse, le sulfure de zinc ZnS est peu soluble :
ZnS =(s) Zn2+aq + S2-aq. Ks1 = 10-22.
H2S est un diacide faible : H2S / HS-
: pKa1 = 7 ; HS- / S2- : pKa2 = 12,5.
Domaines de prédominance des
espèces.
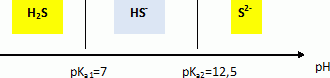
Dans 1 L d'eau on ajoute 1,0 10-2 mol de H2S.
Calcul du pH de la
solution.
Hypothèse : le
pH est inférieur à 7, dans ce cas S2- est négligeable devant
H2S et HS-.
La réaction prépondérante est : H2S + H2O = HS- + H3O+.
|
état
|
avancement
(mol)
|
H2S |
+ H2O |
= HS- |
+ H3O+ |
initial
|
0
|
1,0 10-2 |
solvant
|
0
|
0
|
en
cours
|
x
|
1,0 10-2-x
|
en
large
|
x
|
x
|
à
l'équilibre
|
xéq
|
1,0 10-2-xéq |
excès
|
xéq |
xéq |
|
Le volume de la solution étant de 1 L, on peut
confondre concentration et quantité de matière. On notera xéq
= X.
Ka1 = [HS-] [H3O+] / [H2S] = X2 / (0,01-X) = 10-7.
X2 = (0,01-X)10-7 = 10-9 -10-7
X.
X2 +10-7 X -10-9 = 0
Discriminant D =10-14
+ 4 10-9 ~ 4 10-9 ; D½ =6,3246 10-5.
X = ½(-10-7 +6,3246 10-5) = 3,14 10-5 ; pH = -log X = 4,5. ( l'hypothèse
initile est valide ).
Dans cette solution, on ajoute une masse m
de Na2S solide afin que le pH soit égal à 7.
Calcul de m.
Na2S(s) = 2 Na+aq + S2-aq.
M(Na2S) = 2*23 +32 = 78 g/mol ; quantité de matière d'ion sulfure ajouté : m/M = m/78.
Conservation de l'élément soufre : 1,0 10-2 + m / 78 =
[H2S]+[HS-]+[S2-]
(3)
A pH =pKa1 =7 : [HS-] = [H2S].
(3) s'écrit : 1,0 10-2 + m / 78 = 2[HS-]+[S2-] = [HS-] ( 2 +[S2-] / [HS-] ) (4)
HS-
+H2O=S2-+H3O+
; ka2 =
[S2-][H3O+]/[HS-]
(2)
[S2-] / [HS-] = ka2 / [H3O+], repport dans (4) : 1,0 10-2 + m / 78 =[HS-] ( 2 +ka2 / [H3O+] ) = [HS-] ( 2 +10-12,5 / 10-7 ) ~ 2 [HS-].
[S2-] est donc négligeable devant [HS-] : 1,0 10-2 + m / 78 ~ 2 [HS-] (5)
La solition est électriquement neutre : [Na+] = 2 m / 78 mol/L ;
[Na+] +[H3O+] = 2[S2-] + [HS-] +[HO-]
A pH=7 : [Na+] = 2[S2-] + [HS-] ; 2m / 78 = 2[S2-] + [HS-] ; 2m / 78 ~ [HS-](6)
Repport dans (5) : 3m / 78 = 0,01 ; m = 0,01*78 / 3 = 0,26 g.
Dans un litre de
solution tamponnée à pH 10, on ajoute 0,010 mol de sulfure de zinc ZnS
solide ; une partie se dissout.
Concentrations
des espèces présentes en solution.
ZnS (s)= Zn2+aq + S2-aq. Ks1
=[Zn2+][S2-] = 10-22.
Conservation de l'élément soufre : [S2-] + [HS-] + [H2S]= 0,010.
[HS-] ( [S2-] / [HS-] + 1 + [H2S] / [HS-] ) = 0,010.
Ka2 = [S2-] [H3O+] / [HS-] ; [S2-] / [HS-] = Ka2/ [H3O+] = 10-12,5 / 10-10 = 10-2,5
=3,16 10-3.
Ka1 = [HS-] [H3O+] / [H2S] ; [H2S] / [HS-] = [H3O+] / Ka1=10-10 / 10-7 = 1,0 10-3.
Par suite : [HS-] ( 1 + 1,0 10-3 + 3,16 10-3 ) = 0,010 ; [HS-] =0,010 /1,00416 =9,9586 10-3 ; [HS-]~ 9,97
10-3 mol/L.
[S2-] / [HS-] =3,16 10-3 donne : [S2-] = 3,15
10-5 mol/L.
[H2S] / [HS-] =1,0 10-3 donne : [H2S]= 9,97
10-6 mol/L.
La solution reste électriquement neutre : 2[Zn2+] + [H3O+] = 2[S2-] + [HS-] + [HO-]
[Zn2+] = [S2-] +½([HS-] + [HO-] - [H3O+] )
[Zn2+] =3,15 10-5 +0,5 (9,97 10-3 +10-4 -10-10 ) = 5,1
10-3 mol/L.
Dans un litre
d'eau pure on ajoute : 0,010 mol de ZnS solide et n mole d'un
acide fort.
Analyse
qualitative :
ZnS (s) = Zn2+aq + S2-aq.(0)
S2-aq + 2H3O+aq
= H2Saq + 2H2O(l)
L'ajout d'un acide fort, consomme des ions S2-aq. L'équilibre (0)
est déplacé vers la droite, dissolution du sulfure de zinc solide.
|
pH de dissolution complète de ZnS
:
Relation liant la concentration en
ions sulfure à la concentration en ions
H3O+ et à la concentration en
H2S :
H2S+H2O=HS-+H3O+
; ka1 =
[HS-][H3O+]/[H2S]
(1)
HS-
+H2O=S2-+H3O+
; ka2 =
[S2-][H3O+]/[HS-]
(2)
conservation de l'élément soufre : 1,0 10-2 =
[H2S]+[HS-]+[S2-]
(3)
(1) s'écrit :
[HS-]=
ka1[H2S]/[H3O+]
repport dans (2) :
ka2 =
[S2-][H3O+]²/(
ka1[H2S]) ;
[H2S]=
[S2-][H3O+]²/(
ka1ka2 )
(2) s'écrit :
[HS-] =
[S2-][H3O+]/
ka2
repport dans (3) : 1,0 10-2 =
[S2-][H3O+]²/(
ka1ka2 ) +
[S2-][H3O+]/
ka2 + [S2-]
1,0 10-2 = [S2-] ( 1 +
[H3O+]/ ka2
+[H3O+]²/(
ka1ka2 ) )
1,0 10-2 = [S2-] ( 1 + h/
ka2 +h²/( ka1ka2 )
)
[S2-]
=1,0 10-2 /(1 + h/ ka2 +h²/(
ka1ka2 ))
[S2-] =1,0 10-2 /( 1+
1012,5h + 1019,5 h²).
A dissolution complète : [Zn2+] =0,01 mol/L ;
[S2-] = Ks1 / [Zn2+] = 10-22 / 0,01 = 10-20.
10-20( 1+
1012,5h + 1019,5 h²) = 0,01.
1+
1012,5h + 1019,5 h2 = 1018.
1012,5h + 1019,5 h2 - 1018 ~0.
h2 + 10-7h - 10-1,5= 0 ; h2 + 10-7h - 3,16 10-2= 0.
Résoudre : h ~8,9 10-2 mol/L ; pH = -log 8,9 10-2 =1,051 ~ 1,1.
Quantité de matière d'acide fort ajouté.
Le pH final est pH=1,1 : H2S prédomine par rapport à HS- et S2-.
S2-+2H+ajouté = H2S ( réaction totale).
La quantité de matière d'ion oxonium réagissant est égale à deux fois la quantité de matière initiale d'ion sulfure
n(H+réagissant ) = 0,02 mol.
Quantité de matière initiale d'ion oxonioum : n(H+initiale ) = 10-7 mol.
Quantité de matière finale d'ion oxonioum : n(H+finale ) = 10-1,051 = 8,9 10-2 mol.
n(H+ajouté ) = n(H+finale )+n(H+réagissant ) -n(H+initiale ) ;
n(H+ajouté ) = 8,9 10-2 + 0,02 - 10-7 = 0,11 mol.
|
|
