|
QCM
de chimie, déshydratation, hydrures : Examen technicien
laboratoire école des Mines 2008 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Indiquer la formule de l'acide sulfurique. a) HCl ; b) H2SO4 ( Vrai ) ; c) je ne sais pas. L'hydroxyde de sodium est-il habituellement considéré comme un acide ? a) oui ; b) non ( Vrai ) ; c) je ne sais pas. L'hydroxyde de sodium ( soude ) est une base. La réaction, entre une solution aqueuse d'acide chlorhydrique et une solution aqueuse d'hydroxyde de sodium, donne t-elle des ions Cl-, Na+ et de l'eau ? a) oui ( Vrai ) ; b) non ; c) je ne sais pas. (Na+aq + HO-aq) + (H3O+aq + Cl-aq) = Na+aq + Cl-aq + 2H2O(l). L'acide chloroéthanoïque possède un pKa de 2,86 alors que l'acide éthanoïque a un pKa de 4,76. L'acide éthanoïque est-il un acide plus faible que l'acide chloroéthanoïque ? a) oui ( Vrai ) ; b) non ; c) je ne sais pas. Il faudrait préciser " à concentration égale", l'acide le plus faible a le plus grand pKa. Cocher la case en face du composé qui vous semble être un réducteur. a) C ( Vrai ) ; b) CO2 ; c) je ne sais pas. Le potentiel redox E de la demi-réaction suivante est-il donné par l'expression a) ou b) ? MnO4- + 8H+ + 5e- = Mn2+ 4 H2O. 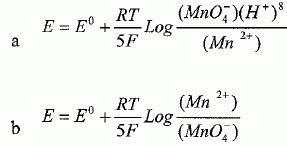 c) je ne sais pas. a) est vrai.
Soit
E°(Fe2+/Fe) = -0,44 V ; E°(Fe3+/Fe) = -0,04 V ; E°(Zn2+/Zn) = -0,76
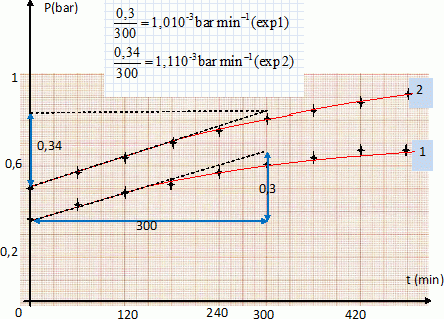
V. a) une seule ( vrai ) ; b) plusieurs ; c) je ne sais pas. CH3-CH (CH3)2. 2-méthylpropane. Un alcène a pour formule semi-développée C2H5-CH=CH-CH3. On réalise une réaction d'addition avec HCl. Quel est le nombre N de formules développées différentes possibles ? a) N=2 ; b) N>2 ( vrai ) ; c) je ne sais pas. C2H5-CHCl-CH2-CH3 ; C2H5-CH2-*CHCl-CH3 ; la présence d'un carbone asymétrique *C conduit à deux énantiomères. L'une des deus solutions est réputée dangereuse au chauffage. Laquelle ? a) chlorure de potassium ; b) perchlorate de potassium ( vrai ) ; c) je ne sais pas. Partie B. On considère la réaction de décomposition d'un corps organique solide cristallisé composé d'une molécule organique notée A et de n molécules d'eau d'hydratation, liées à A à l'état solide. Au chauffage, ce corps se décompose en deux étapes : Etape 1 : il commence par perdre cette eau d'hydratation qui se transforme en vapeur d'eau en phase gazeuse, à des températures T < 450 K. Etape 2 : à plus haute température, la molécule organique A toujours solide, mais maintenant anhydre, se décompose à son tour sous air ou sous oxygène ( sans fusion préalable ) pour donner finalement CO2 et H2O. On admet la formule suivante pour le corps A hydraté solide A, nH2O(s) ; l'anhydre sera noté A(s) et la molécule d'eau vapeur H2O(g). Ecrire la réaction chimique E1 équilibrée correspondant à la première étape. A,nH2O(s) = A(s) + nH2O(g). Calculer la constante d'équilibre K1 de cette réaction ( à une température T fixée) en fonction de la pression partielle en vapeur d'eau PH2O et de n. K1 = (PH2O)n. On étudie cette réaction par un dispositif expérimental ( thermobalance ) permettant de suivre précisément l'évolution de la masse m(t) de l'échantillon constitué de A, nH2O(s) pur au cours du temps t. Le dispositif permet à chaque expérience réalisée de fixer à une valeur constante la pression PH2O autour de l'chantillon, et de faire croître la température T de façon linéaire au cours du temps t : T = at+b avec T = 298 K à t=0 et a = 0,1 K s-1. Soit m0 la masse initiale de l'échantillon. La perte relative de masse Dm(t) / m0 = (m0-m(t) ) / m0 est calculée à chaque instant, donc à chaque température T. La courbe Dm(t) / m0 obtenue présente 2 vagues successives correspondant aux deux étapes E1 et E2 ; elle est donnée ici pour une pression partielle de vapeur d'eau constante P1 =100 Pa.
Masse molaire de A, nH2O : M = MA+ 18 n. Dans une mole, proportion massique d'eau : 18 n / M ; or le tableau indique que la proportion massique d'eau est égale à 0,019 ( 1,9 %). 18 n / (MA+ 18 n ) = 0,019. La connaissance de MA permet le calcul de n. A.N : MA = 1000 g. 18 n = 0,019 (1000 +18 n) ; 18 n = 19 +0,342 n ; n = 19 / 17,658 =1,08 ~ 1. On note après une série d'expériences réalisées pour des pressions de vapeur d'eau égales à P1, P2, Pi..., les températures T1, T2, Ti.... auquelles la déxhydratation commence à être observée pour la rampe de montée en température a = 0,1 K s-1 supposée assez faible pour que le système reste quasiment à l'équilibre.
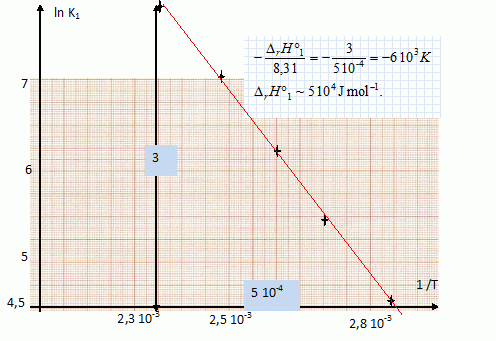
D'une façon générale, comment évoluerait le système si on quittait l'équilibre de façon à ce que T augmente à P constante ( indiquer quel composé on formerait ) ? Les réactions de déshydratation étant endothermiques ( enthalpie DrH°1 positive ), à P = cste, une augmentation de température favorise le déplacement de l'équilibre dans le sens direct, formation de vapeur d'eau. On donne la relation entre la constante d'équilibre K1 et la température absolue T ( avec K0 une constante, et R =8,31 J mol-1 K-1 ). K1 = K0 exp (- DrH°1 / (RT) ). Montrer que si l'on trace ln K1 en fonction de 1/T on peut en déduire l'enthalpie standard de la réaction E1. ln K1 = ln K0 - DrH°1 / (RT). La courbe d'équation ln K1 = f(1/T) est une droite de coefficient directeur DrH°1 / R. On admet que n=1. En s'aidant des résultats précédents, calculer DrH°1 . Le signe de cette valeur est-il conforme à celui attendu ? K1 = (PH2O)n = PH2O.
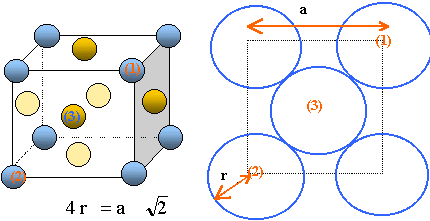
On s'intéresse à la deuxième étape de la décomposition de la molécule A. Des analyses élémentaires de A ont montré la présence de carbone, hydrogène et oxygène. Indiquer les moyens analytiques que vous connaissez pour montrer la présence de ces éléments. Carbone et hydrogène : réaction de combustion complète, en présence d'un excès d'oxygène dans un tube clos. L'eau et le dioxyde de carbone formés sont fixés dans des filtres spécifiques. Oxygène : conversion en monoxyde de carbone ( chauffage à plus de 1100°C en présence d'un excès de carbone et sous un courant de gaz inerte). Partie C : hydrures. Les hydrures sont des composés de l'hydrogène avec d'autres éléments et dans lesquels l'hydrogène est l'élément électronégatif. On distingue plusieurs types d'hydrures : - les hydrures covalents, les hydrures ioniques, les composés d'insertion de l'hydrogène dans un réseau métallique. Nous allons étudier la structure d'un hydrure de palladium qui est un composé d'insertion et la cinétique de décomposition de l'arsine qui est un hydrure covalent. Le palladium cistallise dans le système cubique faces centrées ( cfc). Représenter la maille conventionnelle du paladium.
Calculer le rayon atomique du palladium ainsi que le paramètre de maille du réseau cfc du palladium. Masse d'un atome de palladium : m = MPd / NA =0,10633 / 6,023 1023 =1,765 10-25 kg. Chaque maille compte en propre : - Chaque atome situé au centre d'une face, donc commun à deux mailles compte pour ½ : il y a 6 faces soit 6*0,5 = 3 atomes. - Chaque atome situé à un sommet, donc commun à huit mailles compte pour 1/8 : il y a huit sommets donc 8 /8 atome. par maille : 3+8/8 = 4 atomes propre à une maille. masse de 4 atomes de palladium : 4m =4* 1,765 10-25=7,06 10-25 kg volume de la maille a3 =4 m / rPd =7,06 10-25 / 12030 = 5,87 10-29 m3. a =(5,87 10-29)1/3 =3,886 10-10 ~3,89 10-10 m ~0,389 nm Il y a contact des sphères suivant la diagonale d'une face du cube : 4 r = 2½a ; r = 3,89 10-10*1,414/4 =1,38 10-10 m. Quand on soumet le palladium solide à une forte pression de dihydrogène, il se forme l'hydrure de palladium Pd2H. Dans cet hydrure, les atomes de palladium forment toujours un réseau cfc et les atomes d'hydrogène se situent dans les sites tétraèdriques. La maille possède 8 sites tétraèdriques. Combien de sites tétraèdriques sont-ils occupés par l'hydrogène H ? D'après la formule statistique Pd2H, il y a deux fois plus d'atomes de palladium que d'atome d'hydrogène. Or il y a 4 atomes de palladium propres à une maille, soit 2 atomes d'hydrogène et 2 sites tétraèdriques occupés. Dans Pd2H, le paramètre du réseau cfc du palladium est 0,390 nm. Expliquer l'évolution de ce paramètre de maille lorsqu'on passe de Pd à Pd2H. La présence de deux atomes d'hydrogène dans deux sites tétraèdriques déforme un peu la maille initiale, dont la paramètre augmente légérement.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|