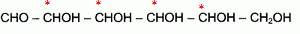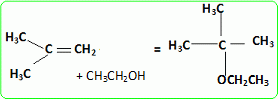|
Concours
technicien laboratoire
2011 : Biocarburants et additifs écologiques. |
||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||
|
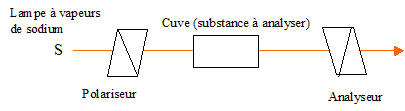
L'éthanol utilisé comme biocarburant ( bioéthanol )est actuellement produit principalement par fermentation du sucre ( saccharose ) extraits de produits agricoles ( betterave, canne à sucre...). La formation du bioéthanol à partir du saccharose se fait en deux grandes étapes : Hydrolyse ou inversion du saccharose (enzyme : invertase) C12H22O11 + H2O = glucose + fructose. Fermentation du glucose : en l’absence de dioxygène C6H12O6 = 2 C2H5OH + 2 CO2. Etude cinétique de la réaction d'inversion du saccaharose. Cette réaction se fait en présence d'une enzyme, qui joue le rôle de catalyseur. La réaction d'inversion peut être également catalysée par des acides. On étudie la cinétique de cette réaction dans une solution tampon phosphorique de pH = 5,0. On donne la loi de Biot pour une solution : a = [a]l, T.C.l a (°) angle de rotation du plan de vibration des ondes lumineuses ; [a] : pouvoir rotatoire spécifique ( ° m2 kg-1 ); C: concentration ( kg m-3 ) ; l : longueur (m) de cuve. Qu'est ce qu'une substance chirale ? comment se manifeste expérimentalement la chiralité ? Quelle particularité structurale possède une molécule chirale ? Une espèce chirale n'est pas superposable à son image dans un miroir ; substance optiquement active : solide, liquide ou substance dissoute en solution provoquant une rotation du plan de polarisation de la lumière polarisée traversant la substance. Cette espèce possède, par exemple un atome de carbone asymétrique, et ne présente aucun élément de symétrie. De quels facteurs dépend le pouvoir rotatoire spécifique d'une espèce ? Quelles sont les conditions expérimentales habituelles utilisées pour les valeurs répertoriées dans les bases de données ? Il dépend de la longueur d'onde de la lumière et de la température. Les valeurs sont données pour la raie D du sodium et une température de 20°C. Donner le schéma de principe légendé d'un polarimètre de Laurent.
L'axe de l'analyseur est
perpendiculaire au polariseur. L'intensité de la
lumière transmise par le dispositif est
nulle.
Le
suivi polarimétrique de la concentration de la solution de
saccharose en fonction du temps t donne les résultats suivants :
vitesse de la réaction : v = 1/V dx/dt avec x : avancement (mol), V : volume de la solution. [S] = [S]0-x/V ; d[S] /dt = -1/Vdx/dt ; v = -d[S] /dt = k[S] ; -d[S] /[S] = k dt. Donner la relation entre (S] et t dans l'hypothèse d'un ordre 1. Intégrer d[S] /[S] = -k dt ; ln [S] = -kt + cste. à l'instant initial t=0, [S] = [S]0 d'où : [S]0 = cste ; par suite : ln([S] / [S]0) = -kt On souhaite vérifier que la réaction d'inversion étudiée est bien d'ordre 1 par rapport à S. Compléter la dernière ligne du tableau. ( voir ci-dessus ). Par une représentation graphique de ln([S] / [S]0) en fonction de t, montrer que la réaction d'inversion est d'ordre 1 par rapport à S. 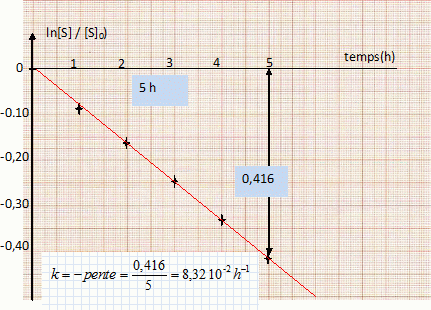 La courbe est une droite, ce qui confirme l'hypothèse de l'ordre 1. Déterminer la valeur de la constante de vitesse k en précisant son unité.( voir graphe ). Définir le temps de demi-réaction et le calculer. t½ =ln2 / k = 8,3 h.
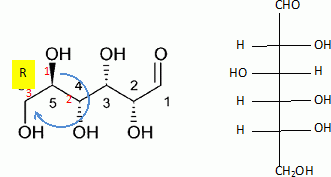
Etude de la réaction de fermentation du glucose, et de quelques propriétés de la molécule de glucose. On donne les enthalpies standard de formation en kJ/mol : DfH°(glucose) = -1260 ; DfH°(CO2) = -393,5 ; DfH°(éthanol) = -277,0 ; M(glucose) = 180 g/mol. Formule semi-développée du glucose : CHO- CHOH- CHOH-CHOH-CHOH-CH2OH. Donner la représentation de Lewis de la molécule de dioxyde de carbone. Indiquer sa structure spatiale, en précisant la valeur des angles de liaisons. La molécule de dioxyde de carbone est une molécule linéaire dont la représentation de Lewis est la suivante : La réaction de fermentation du glucose s'accompagne d'un dégagement de chaleur.
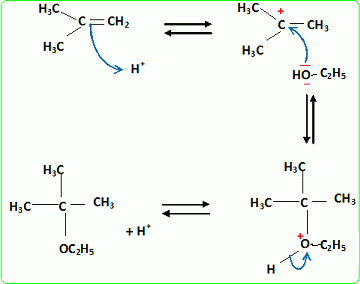
Quel est le rôle joué par H+ ? Il s'agit d'un catalyseur, qui augmente la vitesse de la réaction. H+ intervient dans la première étape ; H+est régénéré dans la dernière étape : il n'apparait pas dans le bilan. L'éthanol utilisé doit être le plus anhydre possible, afin d'éviter la réaction parasite de l'eau sur l'isobutène. Ecrire l'équation de cette réaction et nommer le composé obtenu. 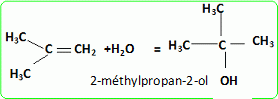 Une autre synthèse est possible par réaction entre le 2-méthylpropan-2-olate de sodium et l'iodure de méthyle. Ecrire l'équation de la réaction en faisant apparaître les formules semi-développées ou topologiques. 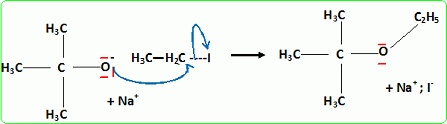 Réaction de Williamson ; un mécanisme de type SN2 est plus probable que la substitution SN1 : le carbocation primaire CH3-CH2+ est peu stable et le carbone de C2H5I est très peu encombré. D'autre part l'alcoolate est un nucléophile très fort. Comment obtient-on le 2-méthylpropan-2-olate de sodium à partir du 2-méthylpropan-2-ol. Ecrire l'équation de la réaction correspondante. On obtient un alcoolate en faisant réagir du sodium sur un alcool : ROH + Na = RO- + Na+ +½H2(g). Il ne faut pas que le solvant puisse réagir avec l'alcoolate : le solvant doit être aprotique. |
||||||||||||||||||||||||||||
| |
||||||||||||||||||||||||||||
|
|