|
Concours technicien laboratoire
2011 : la pile lithium air, préparation d'une solution tampon. |
|||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||
|
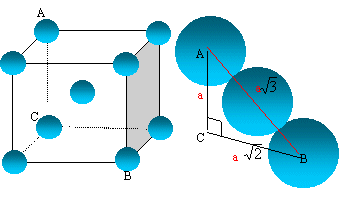
Aux températures ordinaires, le lithium cristallise dans le système cubique centré. Indiquer la structure électronique d'un atome de lithium. Indiquer la place de l'élément lithium dans la classification périodique. A quelle famille appartient-il ? Z =3 : 1s2 2s1. Famille des alcalins ( 1ère colonne ) ; seconde période ( ligne ). Justifier succinctement la formation de l'ion Li+. L'atome de lithium perd facilement son seul électron externe et donne l'ion Li+ ( structure électronique 1s2 ). Cet ion possède une couche électronique externe saturée. Calculer la masse en kg d'un atome de lithium. On donne NA =6,02 1023 mol-1 ; masse atomique molaire du lithium M = 6,94 g/mol. m = M / NA= 6,94 10-3 / 6,02 1023=1,1528 10-26 ~ 1,15 10-26 kg. Représenter la maille élémentaire du lithium. Combien chaque maille contient-elle d'atomes de lithium ?
La tangence s'effectue suivant la grande diagonale du
cube : a
racine carrée (3) = 4 R.
Accumulateur
lithium-air. ½O2 +2H++2e- = H2O. n(e-) = 4 n(O2). Donner l'équation globale de fonctionnement de la pile Li-air. ½O2 +2H++2Li = H2O + 2Li+. Donner l'expression de la loi de Nernst pour chaque couple. E1 = E°(Li+/Li) +0,06 log [Li+] E2 = E°(O2/H2O) +0,03 log([H+]2 P½O2). Expliciter la définition de la force électromotrice standard de la pile Li-air et donner sa valeur à 298 K. E° =E°(O2/H2O)-E°(Li+/Li) = 1,23 -(-3,04) =4,27 V. Faire un schéma de la pile ainsi constituée. 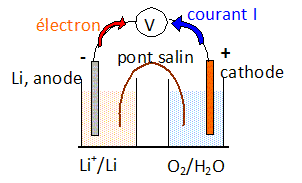 Donner la relation liant l'intensité I délivrée ( supposée constante ), la quantité de charge échangée Q et la durée de fonctionnement Dt. Exprimer ensuite Q en fonction du nombre de moles d'électrons échangés ne. Q = I Dt = ne F avec F, le faraday. Donner la relation entre le nombre de moles de lithium consommé nLi et la masse de lithium correspondante mLi. nLi = mLi / M avec M masse atomique molaire du lithium. Donner la relation entre le nombre de moles de dioxygène consommé nO2 et le volume à 298 K de dioxygène correspondant VO2. nO2 = VO2 / Vm avec Vm = 24,5 L/mol, volume molaire des gaz dans les conditions de l'expérience. A.N : I = 1,00 A; Dt = 1,00 h. Q =1,00 *3600 = 3600 C ; ne = Q / F =3600 / 96500 =3,731 10-2 mol d'électrons. mLi = nLi M = 3,731 10-2 *6,94 =0,259 g. n(O2). =n(e-) / 4 =3,731 10-2 /4 =9,3275 10-3 mol. VO2 = nO2Vm =9,3275 10-3 *24,5 =0,228 L.
Préparation d'une solution tampon. On donne H3PO4 / H2PO4- : pKa1 = 2,1. H2PO4- / HPO42- : pKa2 = 7,2 . HPO42- /PO43- : pKa3 = 12,4. On cherche à préparer un litre de solution tampon de pH = 5,0 et de concentration totale en espèce phosphorée c = 0,10 mol/L. La préparation s'effectue à partir d'une solution concentrée d'acide phosphorique, à laquelle on ajoute de l'hydroxyde de sodium NaOH ( soude ) pour atteindre la valeur du pH désirée. Donner les propriétés d'une solution tampon. Une solution tampon modère les variations de pH suite à l'addition d'une quantité modérée d'acide fort ou de base forte. Le pH d'une solution tampon ne varie pas lors d'une dilution modérée. On dispose d'une bouteille de solution commerciale d'acide phosphorique H3PO4 sur laquelle figurent les informations suivantes : pourcentage massique : 85,0 % ; densité d = 1,71 ; masse molaire M = 98,0 g/mol.  Que signifie le pictogramme ? Quelles sont les précautions à prendre lors de sa manipulation ? La solution commerciale est corrosive : port de gants, lunettes de protection et blouse. Déterminer la concentration molaire apportée en acide phosphorique de la solution commerciale. Masse de 1 L de solution : 1710 g ; masse d'acide pur : m = 1710*0,850 = 1453,5 g. Quantité de matière d'acide phosphorique : n = m / M =1453,5 / 98 = 14,8316 ~14,8 mol dans 1 L. Calculer le volume de solution commerciale à prélever en vue de la préparation d'un litre de solution S de concentration apportée en acide phosphorique c = 0,10 mol/L. Facteur de dilution F = concentration mère concentration fille = 14,832 /0,1 = 148,32. Volume à prélever : 1000 / 148,32 ~6,7 mL. Décrire avec précision les différentes étapes du mode opératoire suivi pour la préparation de cette solution S. Prélever à la pipette graduée ( + pipeteur ) 6,7 mL de solution commerciale. Verser dans une fiole jaugée de 1,00 L contenant environ 200 mL d'eau distillée. Compléter jusqu'au trait de jauge avec de l'eau distillée. Boucher, agiter pour rendre homogène. Calculer le pH de la solution S d'acide phosphorique de concentration c =0,10 mol/L. Le tableau ci-dessous est réalisé pour un volume V = 1 L.
xf2 = 7,94 10-3(0,10-xf) ; xf2 +7,94 10-3xf - 7,94 10-4=0 Résoudre : D = (7,94 10-3)2+4*7,94 10-4=3,24 10-3 ; D½ =5,69 10-2. xf =½(-7,94 10-3+5,69 10-2) =2,45 10-2 mol dans 1 L ; pH = - log 2,45 10-2 =1,61 ~1,6.
[H3PO4] =(nA-nB) / V ; [H2PO4-] =nB/ V. En déduire l'expression du pH de la solution en fonction de nA, nB et pKa1. pH = pKa1 + log( [H2PO4-] / [H3PO4] ) = pKa1 + log(nB / (nA-nB)). En déduire la valeur du rapport nB / (nA-nB) puis de nB. log(nB / (nA-nB)) = pH- pKa1=5-2,1 = 2,9 ; nB / (nA-nB) = 102,9 = 794,3. nB =794,3 (nA-nB) ; 795,3 nB = 794,3 nA avec nA = cV = 0,10 mol. nB =79,43 /795,3 =9,987 10-2 ~0,10 mol. Masse de soude : m = nB M = 0,10*40 = 4,0 g. |
|||||||||||||||||||||||||||||||||||||||||||||||||||
| |
|||||||||||||||||||||||||||||||||||||||||||||||||||
|
|