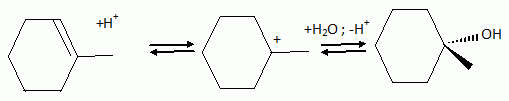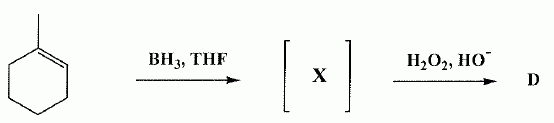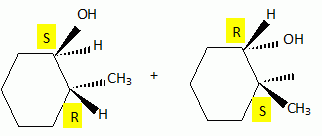|
Concours
assistant d'ingénieurs : techniques d'analyse chimique 2010
( Reims ) MTBE,
les méthylcyclohexanol. |
|||||||
|
|||||||
|
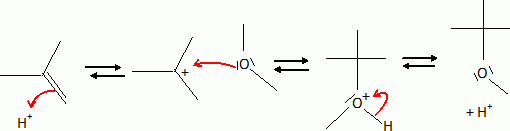
Le 2-méthylpropan-2-ol est chauffé en milieu acide sulfurique. Quel composé obtient-on majoritairement ? Donner un schéma réactionnel expliquant le comportement de cet alcool. En milieu acide concentré l'alcool est protoné. L'eau est un bon groupe partant. Cette étape, de formation du carbocation le plus stable, est réversible et cinétiquement déterminante. La seconde étape ( déprotonation ) est rapide. On obtient majoritairement le 2-méthylpropène. 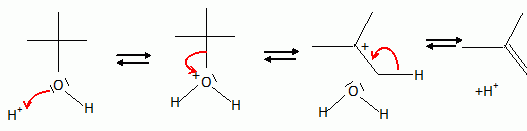 Le 2-méthylpropan-2-ol est aussi connu sous un autre nom. Lequel ? Terbutanol. Le 2-méthyl-2-méthoxypropane est utilisé dans les essences sans plomb. Ce composé est aussi connu sous un autre nom. Lequel ? Méthyl terbutyl éther.
Que donne le
chauffage en milieu acide d'un mélange équimolaire de méthanol et de
2-méthylpropan-2-ol ? Chromatographie, dosage du méthanol restant. La CCM ( chromatographie sur couche mince ) est une technique très utilisée pour une analyse rapide,du produit de la réaction. Ce sera le cas pour cette synthèse. Sur une plaque CCM de 3 cm sur 8 cm, à l'aide d'un capillaire, on place une microgoutte de brut de la réaction décrite ci-dessus, et en référence nous prendrons le 2-méthylpropan-2-ol, produit de départ. L'éluant utilisé est un mélange 5% d'acétate d'éthyle et 95 % d'hexane. Quel sera le produit qui sera retenu et aura donc le Rf le plus petit ? Dessinez la plaque matérialisant cette analyse. Définir le Rf. Le support fixe, la plaque de silice acide est polaire ; l'éluant ( hexane) est apolaire. Le mélange réactionnel contient le méthanol, le 2-méthylpropan-2-ol et le MTBE. Le méthanol, espèce la plus polaire a une grande affinité pour le support fixe : il aura le Rf le plus faible. Le 2-méthylpropan-2-ol, le moins polaire, éluera le plus vite. 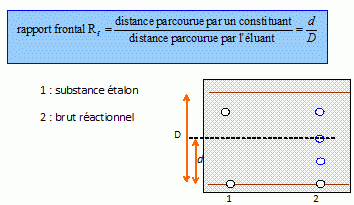 Si vous choisissez de purifier le produit par distillation, pouvez-vous indiquer l'ordre de sortie des composés dans les ballons récepteurs. L'espèce la plus volatil distille en premier : MTBE ( Téb = 55°C) ; méthanol ( Téb = 65°C) ; 2-méthylpropan-2-ol ( Téb = 83°C ) sous une pression de 1 bar. Pourquoi est-il nécessaire d'ajouter du MTBE dans l'essence sans plomb ? Le MTBE améliore l'indice d'octane et la combustion ; c'est un anti-détonnant. Pourquoi l'utilisation de ce produit est-elle abandonnée ? En cas de fuites dans les cuves de stockage, le MTBE se dissout dans l'eau ; c'est une substance difficile à dégrader.
Autour des méthylcyclohexanol. Le 2-méthylcyclohexanol, noté A, est chauffé en présence d'une faible quantité d'acide sulfurique. Quel type de réaction observe t-on ? Quel est le produit majoritaire B obtenu ? Réaction d'élimination ( de H2O ) et formation majoritairement de l'alcène le plus substitué ( 1-méthyl cyclohexène ). Pourquoi ce type de réaction est-elle réversible ? Il existe une réaction inverse, l'addition d'eau sur un alcène. L'hydratation d'un alcène s'effectue avec un acide dilué ; la déshydratation d'un alcool se fait à chaud avec un acide concentré. Comment déplacer l'équilibre vers B ? Eliminer l'alcène du milieu réactionnel au fur et à mesure de sa formation. On choisit de suivre l'avancement de cette réaction en CPG ( chromatographie en phase vapeur ). On travaille avec une colonne semi-capillaire de 12 m, diamètre intérieur 0,22 mm, épaisseur du film 1 µm. les conditions d'injection sont : injecteur 220°C, détecteur 240 °C, température du four 50°C, débit 0,15 L/min, gaz vecteur azote. Injection d'un volume de 0,1 µL. Le temps de rétention du 2-méthylcyclohexanol A est de 2,0 min et du produit de réaction B est de 8 min. A t-on utilisé une colonne apolaire ou polaire ? Justifier. Le 2-méthylcyclohexanol A est polaire alors que le 1-méthylcyclohexène B est apolaire. Le temps de rétention de A est inférieur à celui de B. A a moins d'affinité pour le support fixe que B : la colonne est donc apolaire. La largeur du pic de base du composé B est w = 0,07 min. Calculer le nombre de plateaux théoriques N ainsi que la hauteur équivalente H d'un plateau théorique. N = 16 (tR/w)2 = 16 (8/0,07)2 =2,1 105. H = L / N = 12 / 2,1 10= 5,7 10-5 m. Pour déterminer le rendement de la réaction par CPG, comment procéderiez-vous ? Masse du soluté injecté mechan ; surface du pic : Aéchan ; mechan = k Aéchan. ( k est une constante ). Faire un étalonnage préalable avec un étalon de concentration voisine. meta = k Aéta ; mechan = meta Aéchan / Aéta. Ce produit est purifié par distillation fractionnée. 5 g d'alcool A fournissent 4 g d'alcène B pur. Calculer le rendement. M(alcool) = M(C7H14O) = 7*12+14+16 = 114 g/mol. M(alcène) = M(C7H12) = 7*12+12 = 96 g/mol. Quantité de matière expérimentale : n(alcool) = 5/114 = 4,39 10-2 mol ; n( alcène ) = 4 / 96 = 4,16 10-2 mol. A partir de 4,39 10-2 mol d'alcool on peut théoriquement obtenir 4,39 10-2 mol d'alcène. Rendement : 4,16 / 4,39 = 0,95 ( 95 % ). Pour confirmer la structure du produit B, quelle (s) méthode(s) d'analyse(s) spectroscopique(s) pourriez-vous utiliser en complément de la RMN ? Spectrographie de masse , IR. La microanalyse ou l'analyse centésimale nous donne t-elle une idée sur la structure du produit ? Justifier. Non : elle nous donne la formule brute et permet de calculer le nombre d'insaturations. A.N : C : :87,45 % ; H = 12,49 %. Est-ce en accord avec les valeurs atendues pour B ? Formule brute de B : CxHy. 12 x / %C = y / %H = MB/100 ; x =0,96 *87,45 / 12 ~ 7 ; y = 0,96*12,49 = 12. ( donc accord ).
|
|||||||
| |
|||||||
|
|