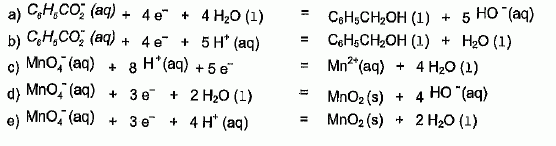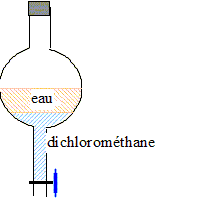|
L'oxydation de l'alcool benzylique par les ions permanganate
s'effectue en milieu basique. L'équation chimique de la réaction
d'oxydoréduction qui se produit s'écrit :
3C6H5CH2OH (l) + 4 MnO4-aq
= 3C6H5CO2-aq
+ 4H2O(l) +4MnO2(s) + HO-aq.
les couples oxydant / réducteur mis en jeu lors de cette synthèse
de l'acide benzoïque sont :
C6H5CO2-aq
/C6H5CH2OH
(l) et MnO4-aq
/MnO2(s)
Choisissez
les deux demi-équations électroniques associées à la transformation
décrite ci-dessus. Justifier.
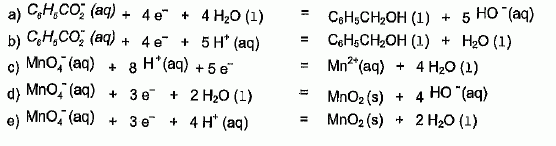
En milieu basique H+aq est minoritaire devant HO-aq.
On élimine donc b), c) et e), demi-équations contenant l'espèce
minoritaire H+aq.
L'arôme
naturel de menthe.
L’arôme
naturel de menthe est principalement dû à deux molécules : le menthol
et la menthone que l’on trouve dans l’huile essentielle
de menthe. Cette dernière est extraite à partir des feuilles de
menthe. On donne quelques caractéristiques physiques :
he. Cette dernière est extraite à partir des feuilles
de menthe. On donne quelques caractéristiques physiques
|
huile essentielle de menthe |
dichlorométhane |
eau salée saturée |
|
densité par rapport à
l'eau |
0,9 |
1,3 |
1,1 |
|
solubilité dans l'eau |
faible |
quasi-nulle |
|
|
solubilité dans l'eau salée |
très faible |
quasi-nulle |
|
solubilité dans le dichlorométhane |
importante |
|
quasi-nulle |
|
menthol |
dichlorométhane |
menthone |
|
température d'ébullition |
212°C |
40°C |
207°C |
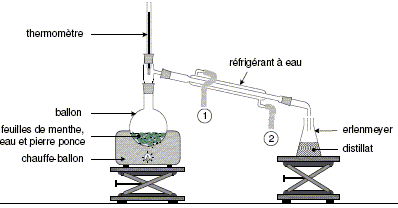
Pour extraire l’arôme naturel de menthe au laboratoire,
on utilise le montage schématisé cidessous :
|
Quel est le nom du
procédé d’extraction
correspondant à ce montage
?
hydrodistillation.
Sur la figure la
légende 1 correspond-elle à
l’entrée ou à la sortie de
l’eau ? Préciser le rôle du
réfrigérant.
(1) : sortie de l'eau ;
(2) : entrée de
l'eau.
Dans le
réfrigérant à eau,
les
vapeurs qui se
dégagent du ballon se
condensent dans le réfrigérant à eau.
Le distillat obtenu est trouble car il
contient deux phases mal séparées :
l’huile essentielle de menthe et l’eau.
Afin de faciliter leur séparation, on ajoute
une solution aqueuse saturée de chlorure de
sodium dans le distillat recueilli. On place
ensuite le contenu de l’erlenmeyer dans une
ampoule à décanter. On verse du
dichlorométhane dans l’ampoule puis
après agitation et décantation, on
recueille la phase organique. On ajoute du sulfate
de magnésium anhydre à la phase
organique afin de la sécher. Après
filtration, on procède à
l’évaporation du solvant à
l’aide d’un évaporateur rotatif
afin d’isoler l’huile essentielle de
menthe.
A l’aide du
tableau des caractéristiques physiques,
justifier l’ajout de chlorure de sodium dans
le distillat.
L'huile essentielle de menthe
est très faiblement
soluble dans l'eau salée.
Citer deux raisons qui
justifient le choix du dichlorométhane comme
solvant extracteur.
- Le dichlorométhane et l'eau
sont deux solvants non miscibles
- l'huile essentielle de menthe est
très soluble dans le
dichlorométhane.
|
Faire un
schéma de l’ampoule à
décanter en indiquant la position des phases
aqueuse et organique obtenues.
Justifier.
Le liquide le plus
dense, le dichlorométhane
contenant la majorité de l'l'huile
essentielle occupe la
partie inférieure.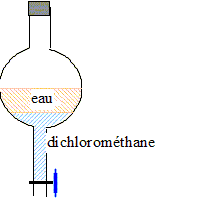
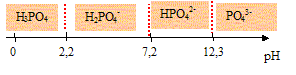
L'acide othophosphorique.
H3PO4 est un triacide dont les pKa sont : pKa1 = 2,2 , pKa2 = 7,2 ; pKa3 =12,3.
Représenter sur un axe horizontal, le domaine de prédominance des espèces en fonction du pH.
les domaines de prédominance des
espèces H3PO4,
H2PO4-,
HPO42- et PO43-
:
Vous désirez préparer 1 L de tampon
phosphate 0,05 mol/L à pH=7,2. Vous disposez de
NaH2PO4,2H2O d'une
puteté de 98 %, de
Na2HPO4,12H2O et d'eau
distillée.
De quelle façon procédez
vous ? Indiquer succinctement les étapes
nécessaires ainsi que les résultats de
calculs éventuels.
- Quelles sont les propriétés d'une
solution tampon ?
H : 1 ; O : 16 ; Na : 23 ; P : 31 g/mol.
Mélanger 0,5 L de solution de
NaH2PO4 à 0,1 mol/L et 0,5 L de
solution de Na2HPO4 à 0,1 mol/L
; dans le mélange ( facteur de dilution = 2) , les
concentrations de chaque ion seront : 0,05 mol/L
Quantité de matière (mol) correspondante =
volume (L) * concentration (mol/L) : n = 0,1*0,5 = 0,05
mol
masse molaire
NaH2PO4,2H2O : M=
23+2+31+64+2*18 = 156 g/mol
masse (g) = M*n= 156*0,05 = 7,8 g
masse à peser, en tenant compte de la
pureté : 7,8 / 0,98 = 7,96
g.( dissoudre dans 0,5 L d'eau
distillée)
masse molaire
Na2HPO4,12H2O : M=
46+1+31+64+12*18 = 358 g/mol
masse (g) = M*n= 358*0,05 =17,9
g.
Propriétés d'une solution tampon :
modère la variation du pH, faisant suite à
l'ajout modéré d'acide ou de base forte.
le pH ne varie pas par dilution.
Quelle est la proposition exacte ?
Une réaction qui se produit avec une absorption de chaleur est une réaction :
a) adiabatique ; b) endothermique ( Vrai) ; c) exothermique.
L'estérification est :
a) une condensation d'un alcool sur un acide ( Vrai)
b) une hydrolyse acide d'un ester.
c) une condensation d'un alcool sur une base.
Quel rayonnement peut être arrêté par une simple feuille de papier ?
a) un rayonnement alpha ( Vrai) ; b) un rayonnement g ; c) un rayonnement ß.
Quelle est
parmi les températures ci-dessous celle qui est la plus proche de la
température d'ébullition de l'hélium liquide ( à pression atmosphérique
) ?
a) +30°C ; b) -20 °C ; c) -80°C ; d) -190°C ; e) -270 °C ( Vrai).
Comment se conserve en toute sécurité le sodium à l'état solide ?
a) dans l'eau à 15°C ; b) dans l'huile ( Vrai) ; c) à l'air libre.
Un volume de 1 dm3 correspond à :
a) 10 mL ; b) 100 mL ; c) 1000 mL ( Vrai).
Quel est le couple de solvant miscible ?
a) eau / éthanol ( Vrai) ; eau / chloroforme ; eau / hexane.
Citer 3 équipements de protection individuelle.
Blouse, gants, lunettes et chaussures de sécurité.
le laboratoire dispose de bidons de récupération pour les déchets
chimiques. Indiquer par une croix dans le tableau, l'endroit où vous
jeteez les solutions suivantes.
composé
|
acide minéral
|
acide organique
|
base et sel de métaux
|
solvant
|
évier
|
méthanol
|
|
|
|
X
|
|
acide sulfurique
|
X
|
|
|
|
|
soude
|
|
|
X
|
|
|
acide formique
|
|
X
|
|
|
|
chlorure de sodium 10-4 M
|
|
|
|
|
X
|
dichromate de potassium
|
|
|
X
|
|
|
KOH
|
|
|
X
|
|
|
HNO3
|
X
|
|
|
|
|
CH3COOH
|
|
X
|
|
|
|
FeCl3
|
|
|
X
|
|
|
|
Que signifie les symboles suivants :

Qu'utilise t-on pour éteindre un feu de solvants ?
a) un extincteur eau-additif ( Vrai ) ; b) un extincteur à CO2 ; c) un extincteur poudre pour feux de métaux.
Un compteur Geiger-Müller est utilisable pour détecter :
a) une atmosphère explosive ; b) un dégagement de monoxyde de carbone ;
c) des rayonnements ionisants ( Vrai ).
Identifier les réactions suivantes :
réaction
|
type de réaction
|
2I-+2S2O32- = I2 + S4O62-
|
oxydoréduction
|
CO2 + H2O + HO- = HCO3- + H2O
|
acide base
|
2MnO4- + 5H2C2O4 +6H+ = 2Mn2+ +10CO2 +8H2O
|
oxydoréduction
|
CH3-COO-CH2-C6H5 + H2O = CH3-COOH + C6H5CH2OH
|
hydrolyse d'un ester
|
2H2O = H3O+ + HO-.
|
autoprotolyse de l'eau
|
Les propositions suivantes sont-elles vraies ou fausses ?
D'une manière générale, la vitesse d'évolution d'un système chimique croït avec la température ( Vrai ).
D'une manière générale, la vitesse de formation d'un produit dépend de sa concentration ( Faux).
D'une manière générale, la vitesse de disparition d'un réactif dépend de sa concentration ( Vrai ).
|
|