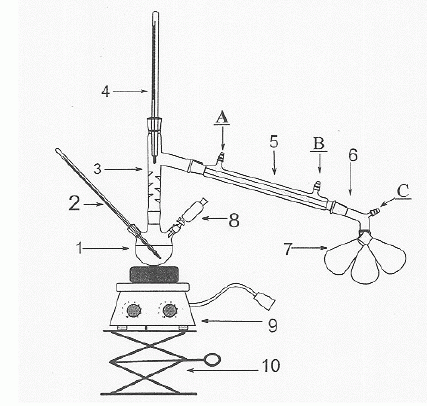
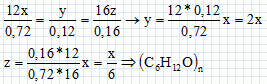|
Préparateur en chimie : concours ATPL2 2009 Montpellier. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Dilution. On dispose d'une solution aqueuse de soude de concentration 1 mol/L. Comment procède t-on pour préparer 200 mL d'une solution aqueuse de soude de concentration 5 10-2 mol/L ? Facteur de dilution = concentration mère / concentration fille ; F = 1/0,05 = 20. Volume de la fiole jaugée : 200 mL ; volume de la pipette jaugée : 200 / 20 = 10 mL. Prélever 10 mL de solution mère à l'aide d'une pipette jaugée. Verser dans une fiole jaugée de 200 mL, compléter avec de l'eau distillée jusqu'au trait de jauge. Boucher et agiter pour rendre homogène. Acide sulfurique H2SO4. Calculer la masse molaire de l'acide sulfurique. M=2+32+4*16 = 98 g/mol. Pour préparer un litre de solution d'acide sulfurique de concentration 0,1 mol/L, on dispose d’une solution commerciale à 98% en masse (d = 1,8) et d’eau distillée. Indiquer précisément la manière de procéder, le nom des accessoires et les précautions à prendre. Masse de 1 L de solution commerciale : 1,8 kg = 1800 g Masse d'acide sulfurique pur : 1800*0,98 =1764 g Concentration ( quantité de matière dans 1 L) : m/M = 1764 / 98 = 18 mol/L Facteur de dilution = concentration mère / concentration fille ; F = 18/0,1 = 180. Volume de la fiole jaugée : 1000 mL ; volume de la pipette graduée : 1000 / 180 = 5,6 mL. Prélever 5,6 mL de solution mère à l'aide d'une pipette graduée. Verser dans une fiole jaugée de 1000 mL contenant un tiers d'eau distillée, compléter avec de l'eau distillée jusqu'au trait de jauge. Boucher et agiter pour rendre homogène. Port de gants, blouse et lunette de protection.
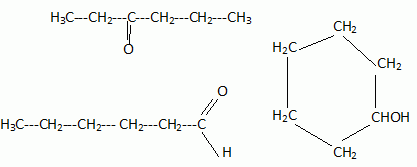
2N2O5 --> 4 NO2 + O2. Écrire la formule semi-développée du 2,3-diméthylpentane. 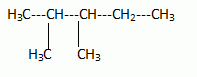 On considère 23892 U  Quelle masse d’acide 6-aminohexanoïque faut-il pour préparer 100 mL d’une solution aqueuse 2.10-2 mol/L de ce composé ? On donne M = 131 g/mol. Quantité de matière n = C V = 0,02 *0,1 = 2,0 10-3 mol. masse = n M = 2,0 10-3 *131 = 0,26 g.
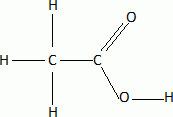
Les
analyses élémentaires de plusieurs composés donnent les mêmes valeurs :
C 72% ; H 12% ; O 16%.
Aire et volume. Un fil
cylindrique a un diamètre d = 3 mm et une longueur l = 50 cm. Quel sera le montant de votre commande ? En sachant que le taux applicable au matériel scientifique est de 19.6%, quel est le prix hors taxe de cette commande ? Prix HT : 400*5 / 1,196 =1672,24 €. Remise 20 % : 1672,24 *0,20 =334,45 €. Prix HT avec remise : 1672,24-334,45 =1337,79 €. Prix à payer : 1337,79*1,196 ~1600 €. Afin de pouvoir choisir la taille de flacons la mieux adaptée aux quantités de produits à conserver, votre prédécesseur a établi un tableau pour connaître le volume approximatif correspondant à la masse des composés cristallisés qu’il était amené à stocker après les avoir synthétisés. La taille des cristaux n’étant pas toujours la même, les conditions opératoires n’étant pas toujours identiques, le tableau est empirique. Les volumes en fonction des masses ne sont donc pas des fonctions rigoureusement linéaires. On peut constater dans ces trois tableaux que certains résultats sont aberrants. Lesquels ? Entourez la masse et le volume supposé correspondant pour les valeurs qui vous semblent aberrantes. Composé n°1 :
Composé n°1 :
4 expérimentateurs, chargés d'étalonner une solution d'acide chlorhydrique, ont chacun effectué 5 mesures sur le même échantillon. Les résultats (concentrations en (mol/L) x1000) qu'ils ont obtenus sont rassemblés dans le tableau suivant. Ils ont pu en déterminer la médiane, la moyenne arithmétique, l'erreur systématique, l'erreur systématique relative, la variance et l'écart-type de leurs mesures. Vous devez conclure quant à la précision et la justesse de leurs analyses, sachant que : L'erreur systématique relative κ, peut être utilisée pour exprimer un critère de justesse : un résultat sera considéré comme juste si κ ≤ 0,5 %. L'écart-type δ peut être utilisé pour exprimer un critère de précision : le résultat sera considéré comme précis si δ ≤ 0,05.10-3 mol/L.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|