|
QCM
de chimie :
concours Kiné 2010 |
|||||||||||||||||||||||||
|
|||||||||||||||||||||||||
|
Le sujet de ce concours n'est pas accessible depuis le site. Réaction autocatalysée : acide oxalique + ion permanganate. L'ion permanganate est la seule espèce colorée ; on peut donc suivre l'évolution de l'absorbance A au cours du temps, à une longueur d'onde pour laquelle l'ion permanganate présente un maximum d'absorption. 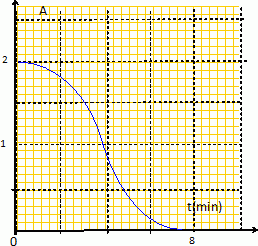 L'absorbance finale étant nulle, l'ion permanganate est le réactif limitant. Au début de cette réaction autocatalysée par l'un des produits Mn2+aq, le catalyseur est en faible quantité et la vitesse est faible. La concentration du catalyseur augmentant au cours du temps, la vitesse de la réaction croît. Mais les concentrations des réactifs diminuent au cours du temps : ce facteur va l'emporter et la vitesse de la réaction va finir par décroître. Réponses a et b. Oxydation des ions iodures par l'eau oxygénée. L'un des produits est le diiode, seule espèce colorée. La réaction est suivie par spectrophotométrie à une longueur d'onde pour laquelle le diiode présente un maximum d'absorption. L'absorbance étant proportionnelle à la concentration [I2 aq], pour les faibles concentrations, et le diiode étant l'un des produits, l'absorbance augmente au cours du temps. Réponses b et d.
L'acide éthanoïque est un acide faible ( taux d'avancement final inférieur à 1, acide partiellement dissociée en solution ). Le pH de cette solution valant pH =3,8, [H3O+] = 10-3,8 =1,6 10-4 mol /L, valeur inférieure à C =1,0 10-3 mol/L . Réponses b et c. pKa du couple ( acide benzoïque / ion benzoate.
Réponse b.
Conductimétrie : ammoniac + acide éthanoïque. s = lNH4+ [NH4+]fin + lCH3COO- [CH3COO-]fin avec [NH4+]fin = [CH3COO-]fin En déshydratant un alcool on obtient un ou deux alcènes. En enlevant une molécule d'eau au butan-1-ol ou au butan-2-ol on peut obtenir le but-1-ène. L'oxydation ménagée d'un alcool primaire ( butan-1-ol ) conduit à un aldehyde puis à un acide carboxylique. Dans les mêmes conditions, un alcool secondaire ( butan-2-ol ) donne une cétone. L'aldehyde donne un test positif avec la DNPH et un test positif avec le réactif de Tollens. La cétone donne un test positif avec la DNPH et un test négatif avec le réactif de Tollens. L'alcool X est donc un alcool secondaire, le butan-2-ol et la cétone B, la butanone. Réponses b et e. Combustion complète d'un composé oxygéné. On donne C : 12 ; H : 1 ; O : 16 g/mol. CxH2xOx + xO2 = x CO2 + x H2O. La combustion complète donne 2 moles de CO2 et 2 moles d'eau à partir d'une mole d'une mole de CxH2xOx : d'où x = 2 C2H4O2 : M =2*12+4+2*16 = 60 g/mol. Réponse c. Quotient de réaction initial Q r i. Volume total de la solution V. Q r i = [HCOO-]i [C6H5COOH]i / ( [HCOOH]i [C6H5COO-]i ) [HCOO-]i = C4V4/V = C1V4/V ; [C6H5COOH]i =C1V1/V = C4V1/V ; [HCOOH]i = C3V3/V = 1,25C1V1/V ; [C6H5COO-]i = C2V2/V = 2C1V2/V ; Q r i =C1 V4 C1V1 / ( 2,5 C1V1 C1V2) = V4 / (2,5 V2) = 2. Réponse c. Obtention du dichlore par électrolyse. Bilan : 2H2O + Cl- aq = Cl2(g) + H2(g) + 2HO-(aq). On donne : 1 F = 96500 C/mol ; volume molaire des gaz Vm = 30 L / mol ; durée de l'expérience Dt ; intensité I. Oxydation des ion chlorure à l'anode positive : 2Cl- aq = Cl2(g) + 2e-. Quantité d'électricité Q = IDt = n F avec n =n(e-) nombre de moles d'électrons. n(e-) = 2 n(Cl2) = IDt / F ; n(Cl2) = IDt / (2F) ; Volume de dichlore : n(Cl2)Vm =IDt Vm/ (2F) = 4825 *20*60 *30/ (2*96500) =600*30/20 =900 L Réponses a et c.
Production de l'aluminium par électrolyse. Réduction de l'ion Al3+ à la cathode négative : Al3+ + 3e- = Al. Oxydation des ions O2- en dioxygène à l'anode positive : 2O2- = O2(g) + 4e-. Réponses d et e. Radioactivité ß-. AZX = AZ+1Y +0-1e Le nombre de nucléons ne change pas ; le nombre de charge augmente de 1. 23992X = 23993Y +0-1e 23993Y = 23994Pu +0-1e Réponse d. Datation au potassium 40. au
départ à t=0, N0 noyaux de
potassium et aucun noyau d'argon.
|
|||||||||||||||||||||||||
| |
|||||||||||||||||||||||||
|
|