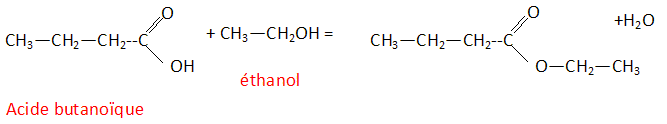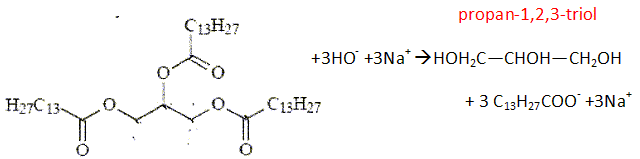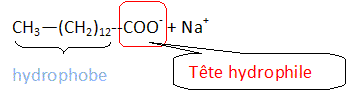|
Quels sont le rôle et les effets d'un
détergent ? concours interne
CAPLP maths sciences 2011 |
|||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||
|
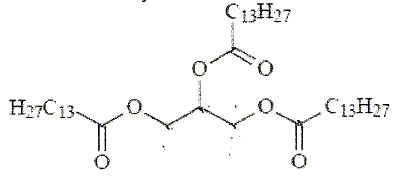
L'étiquette d'un liquide vaisselle indique la composition suivante : entre 5 et 15% agents de surface anioniques ; moins de 5 % agents de surface non anioniques ; parfum, méthylchloroisothiazolinone, octylisothiazolinone, limonène. Les agents de surface sont aussi appelés tensioactifs. ils sont usuellement classés en quatre catégorie : anionique, cationique, non ionique et zwitterionique ( amphotère). Répartir les tensioactifs ci-dessous entre les quatre catégories citées précédemment. 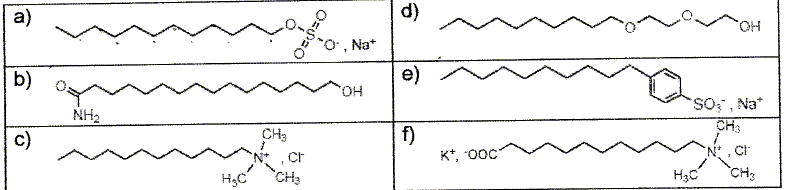 a) et e) anioniques ; c) cationique ; b) et d) non ioniques ; f) amphothère. Quelles fonctions chimiques porte le tensioactif b) ? Le groupe hydroxy OH correspond à un alcool primaire ; le groupe CONH2 correspond à un amide. Que signifie amphotère en chimie des solution ? Donner, en justifiant, un exemple d'espèce chimique amphotère. L'eau est amphotère : elle peut se comporter comme un acide ou comme une base. H2O +H+ = H3O+ ; H2O = HO- + H+. Le tensioactif a) est le dodécylsulfate de sodium SDS. Il est obtenu à partir du dodécan-1-ol par deux réactions successives : on fait réagir tout d'abord du dodécan-1-ol avec l'acide sulfurique, le produit principal conduit au SDS grâce à une réaction acido-basique avec la soude. Ecrire les équations associées à ces deux réactions. C12H25-OH +H2SO4 =C12H25-OSO3H +H2O. C12H25-OSO3H +Na+ +HO- =C12H25-OSO3- +Na+ +H2O.
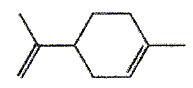
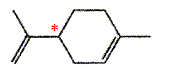
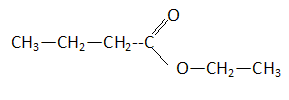
Le limonène est utilisé ici pour son parfum d'agrume. On donne sa formule topologique. Le limonène possède un atome de carbone asymétrique. Les esters sont souvent utilisés comme parfum. Le butanoate d'éthyle présente une odeur d'ananas. Les tensioactifs sont des espèces chimiques amphiphiles constituées d'une partie hydrophile et d'une partie hydrophobe ( lipophile). Donner la signification des mots amphiphile, hydrophile et hydrophobe. Hydrophile : ami de l'eau ( qui a une affinité pour l'eau ) ; hydrophobe : ennemi de l'eau ; amphiphile : l'espèce possède à la fois une partie amphiphile et une autre partie hydrophobe. Proposer une structure générale des tensioactifs en justifiant le caractère hydrophileou hydrophobe de chaque partie. 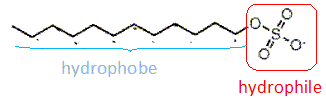 Expliquer à l'aide d'un schéma les propriétés détergentes d'un tensiactif. 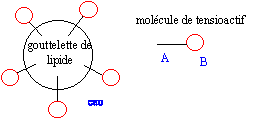 La partie B se trouve dans l'eau : partie hydrophile du tensioactif. Le pouvoir mouillant d’un tensioactif est sa capacité à pénétrer entre les fibres d’un tissu et à s’étaler sur une surface. Préparer deux béchers : l’un contient de l’eau distillée , l’autre de l’eau additionnée de détergent ( eau savonenuse ). Poser à la surface de l’eau dans chaque bécher un petit morceau de de laine. L’eau savonneuse diminue les forces de tension superficielle ; le tissu est imprègné d'eau, il s'alourdit et coule. On qualifie une espèce chimique amphiphile de tensioactif en raison de son action sur la tension de surface d'un liquide. Pour montrer le phénomène de tension de surface et l'effet d'un tensioactif, une expérience simple peut être réalisée avec un trombone, un cristallisoir, de l'eau et du liquide vaisselle. Décrire cette expérience en expliquant ce qu'est la tension de surface. La tension superficielle est la force qu'il faut appliquer à un liquide pour provoquer l'extension de sa surface. Tout objet en contact avec la surface d’un liquide est soumis à une force de tension superficielle exercée par le liquide. On pose doucement un trombone à la surface de l'eau, puis on ajoute du liquide vaisselle : le trombone coule.
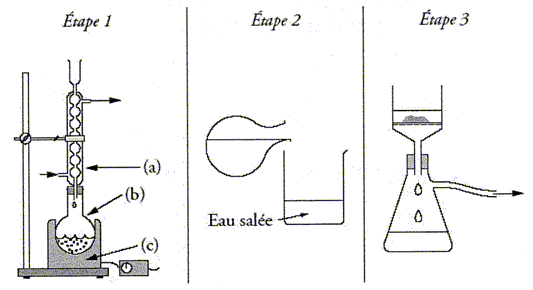
Extraction du limonède par hydrodistillation. Placer dans un ballon bicol des écorces d'orange et remplir à moitié d'eau. Insérer le ballon dans un montage d'hydrodistillation. Lancer le chauffage et recueillir le distillat dans une éprouvette, rajouter si besoin de l'eau dans le ballon au cours du chauffage. Arrêter le chauffage lorsque l'éprouvette est remplie. Légender le schéma. 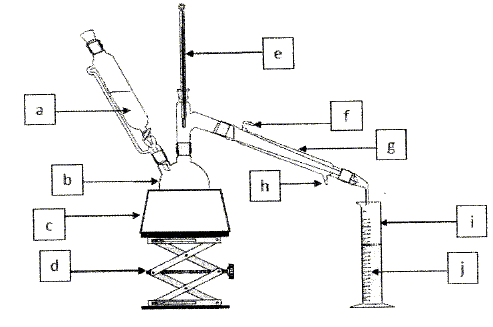 a : ampoule de coulée ( eau ) ; b : ballon bicol ; c : chauffe ballon ; d : élévateur à croisillons ; e : thermomètre ; f : sortie de l'eau ; g : réfrigérant à eau ; h : entrée de l'eau ; i ; éprouvette ; j : distillat ( eau + limonède en surface ). Après avoir isolée l'huile essentielle, on réalise une chromatographie sur couche mince ( CCM). Identification du limonène dans l'huile essentielle. Préparer deux échantillons : le premier échantillon contient 0,5 mL de cyclohexane et une goutte d'huile essentielle, le second contient 0,5 mL de cyclohexane et une goutte de limonène commercial comme référence. Après avoir disposé les deux échantillons sur la plaque de chromatographie, réaliser l'élution. L'éluant utilisé est le cyclohexane. A la fin de l'élution, les espèces chimiques présentes sur la plaques sont révélées par un réactif chimique. Donner le principe physico-chimique de la CCM. La chromatographie permet de séparer et d'identifier les constituants d'un mélange en utilisant la différence de solubilité d'un produit entre une phase fixe et une phase mobile, l'éluant. La révélation est nécessaire, chaque fois que les produits ou réactifs sont incolores. Tracer au crayon à papier une ligne à un peu plus de 1 cm du bas de la plaque . Marquer au crayon sur cette ligne les emplacements où l'on déposera les solutions à analyser. Les emplacements doivent être distants d'environ 1 cm, et à au moins 1 cm des bords. Dépôt de l'échantillon : A l'aide d'une pipette pasteur, ou d'un tube capillaire, déposer une goutte sur la plaque à l'emplacement marqué. Laisser sécher . Si la solution est trop diluée, on peut faire plusieurs dépôts au même emplacement , à condition de bien sécher la plaque entre deux gouttes. Développement du chromatogramme : Lorsque les dépôts sont secs, placer la plaque le plus verticalement possible dans la cuve, ligne de dépôt vers le bas. La surface de l'éluant doit être en de cette ligne. Couvrir. Surveiller la plaque régulièrement : quand l'éluant est à environ 1 cm du bord supérieur, sortir la plaque, marquer le niveau atteint par le solvant au crayon à papier, sécher la plaque. 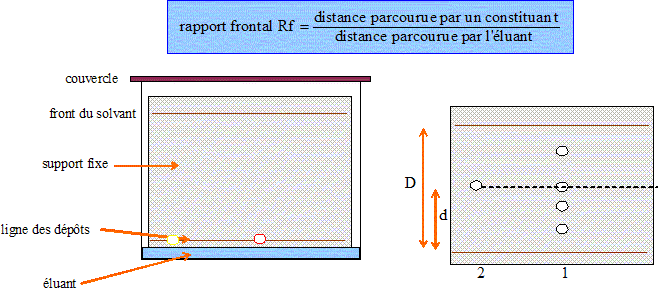 Le diiode peut être utilisé comme révélateur : le diode s'additione sur les liaisons doubles carbone carbone.
Faire un schéma légendé du montage de chauffage à reflux.
a) réfrigérant à eau ; b) : ballon ; c) : chauffe ballon.. En chauffant on accélère la réaction. Le reflux évite toute perte de matière : les vapeurs se condensent dans le réfrigérant et retombent dans le milieu réactionnel. La pierre ponce régularise l'ébullition. Expliquer le principe physico-chimique du relargage. Le savon est quasiment insoluble, à froid, dans une solution concentrée d'eau salée : le savon précipite. |
|||||||||||||||||||||||||||||||
| |
|||||||||||||||||||||||||||||||
|
|