|
Dosage
du vinaigre , conductimétrie : concours interne
CAPLP maths sciences 2011 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
La fermentation alcoolique est le résultat d'une chaîne métabolique qui transforme des sucres de formule C6H12O6 fermentescibles par des levures en alcool et dioxyde de carbone. Ecrire l'équation de la réaction de fermentation alcoolique sachant que pour une mole de sucre il se forme 2 moles de dioxyde de carbone . C6H12O6 = 2C2H5OH + 2CO2. Quel est le test de caractérisation du dioxyde de carbone ? Le dioxyde de carbone trouble l'eau de chaux. La fermentation acétique du vin en vinaigre est définie comme l'oxydation de l'alcool en acide carboxylique par le dioxygène de l'air en présence de mère de vinaigre. Ecrire l'équation de la fermentation acétique. C2H5OH +H2O= C2H4O2 +4H++4e-. Oxydation de l'alcool. O2 + 4H++4e- = 2H2O. Réduction du dioxygène. Bilan : C2H5OH +O2 =C2H4O2 +H2O. Préparation du dosage. Préparation de la solution d'hydroxyde de sodium à partir de pastilles du commerce. Sur l'étiquette de l'emballage commercial de pastilles de soude figurent les informations suivantes :  R35 -
Provoque de graves brûlures. R35 -
Provoque de graves brûlures.Que signifie cepictogramme ? Produit corrosif. Préciser les mesures de sécurité à prendre lors de l'utilisation des pastilles d'hydroxyde de sodium. Port de blouse, gants et lunettes de protection. Décrire les différentes étapes nécessaires à la préparation d'un litre de solution de concentration CB = 0,10 mol/L. Quantité de matière d'hydroxyde de sodium n = CB V =0,10 mol. Masse m = n M = 0,10 *40 = 4,0 g. Mettre une coupelle sur la balance électronique, appuyer sur tare. Prélever 4,0 g de pastilles à l'aide d'une spatule et le mettre sur la coupelle. Placer ces pastilles dans une fiole jaugée de 1 L contenant 200 mL d'eau distillée. Agiter jusqu'à dissolution complète. Compléter jusqu'au trait de jauge avec de l'eau distillée. Agiter pour rendre homogène. Le vinaigre est essentiellement une solution d'alcool et d'acide acétique dans l'eau, qui contient également un grand nombre de composés chimiques volatils ou non, en solution ou en suspension. Il ne peut donc pas être dosé en l'état. Il faut donc le préparer pour le dosage en enlevant toutes les particules et colorants naturels qui le constitue. Décrire le mode opératoire de préparation de 100 mL de solution de vinaigre diluée au 1/10è. Prélever 10,0 mL de la solution mère à l'aide d'une pipette jaugée. Verser dans une fiole jaugée de 100 mL ; compléter avec de l'eau distillée jusqu'au trait de jauge ; agiter pour rendre homogène.
Conductivité
d'un électrolyte. Expliquer
les valeurs élevées des conductivités ioniques molaires équivalentes
limites des ions HO- et H3O+. Donner l'expression de la concentration molaire CA de l'acide éthanoïque dans la solution diluée en fonction de CB, VBE et VA, VA est le volume prélevé de la solution d'acide éthanoïque à doser. CH3COOH aq + HO-aq = CH3COO-aq + H2O. A l'équivalence les quantités de matière des réactifs sont en proportions stoechiométriques. CA VA = CB VBE. Donner l'expression de la concentration C'A de l'acide éthanoïque contenu dans le vinaigre en fonction de CA. La solution mère a été diluée 10 fois : C'A = 10 CA. Donner l'expression de la concentration C'A en fonction de la masse d'acide éthanoïque mA, de la masse molaire moléculaire de l'acide éthanoïque M(CH3COOH) et du volume V de la solution. n = mA / M(CH3COOH) ; C'A = n / V = mA / ( M(CH3COOH) V). mA = C'A V M(CH3COOH). Quelle est la masse m à considérer pour définir le degré du vinaigre. Le degré d'un vinaigre est égal à la masse d'acide acétique pour V =100 mL = 0,1 L de vinaigre mesurés à la température de 20°C. m = C'A *0,1* M(CH3COOH). Donner l'expression du degré d'acidité d en fonction de VBE. C'A = 10 CB VBE / VA ; d = CB VBE / VA M(CH3COOH). M(CH3COOH) = 60,0 g/mol ; masse volumique de l'acide éthanoïque r = 1,02 103 g/L ; VA = 20 mL. A cette solution placée dans le becher ont été ajoutés 100 mL d'eau distillée pour réaliser le dosage conductimétrique ; ainsi,on considèrera par la suite que le volume total Vtot de solution dans le becher est constant.
Titrage de la solution de vinaigre. Légender le dispositif du dosage. 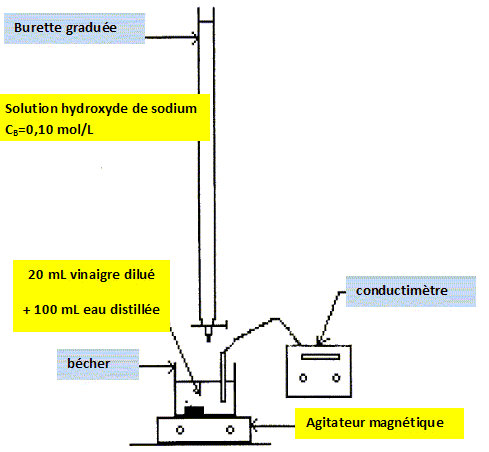 Tracer la courbe représentant la conductivité s en fonction du volume versé VB.
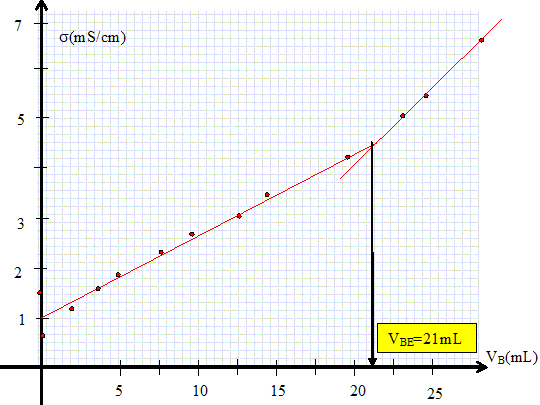 Quels sont les ions présents dans la solution avant le dosage. L'acide éthanoïque est peu ionisé en ion éthanoate et oxonium. L'ion hydroxyde est minoritaire en milieu acide. Exprimer la conductivité initiale de cette solution en fonction de CA et Ka la constante d'acidité du couple CH3COOH / CH3COO-. Ka =[CH3COO-]i [H3O+]i /[[CH3COOH]i] ~[CH3COO-]i [H3O+]i / CA, l'acide étant peu dissocié. La solution est électriquement neutre : [CH3COO-]i =[H3O+]i = (KaCA)½. si = lCH3COO- [CH3COO-]i + lH3O+ [H3O+]i =( lCH3COO-+ lH3O+ ) (KaCA)½. Exprimer la conductivité de la solution, après équivalence. En déduire la pente de la droite obtenue. L'ion hydroxyde est en excès ; la solution contient des ions éthanoate, sodium et hydroxyde. s = lCH3COO- [CH3COO-] + lNa+ [Na+] + lHO- [HO-] [Na+] =CBVB/Vtot ; [HO-] =CB(VB-VBE) /Vtot ; [CH3COO-] = CAVA / Vtot = CBVBE / Vtot. s =( lCH3COO- CAVA + lNa+CBVB + lHO- CB(VB-VBE)) / Vtot. s =( lCH3COO- CBVBE + lNa+CBVB + lHO- CB(VB-VBE)) / Vtot. s =( lCH3COO- CBVBE - lHO- CB VBE + lNa+CBVB + lHO- CBVB) / Vtot. s =( lCH3COO- - lHO- )CB VBE / Vtot +( lNa+ + lHO- )CBVB / Vtot. Droite de pente ( lNa+ + lHO- )CB / Vtot. A.N : (5,01 +19,9 ) 10-3 *0,1 103 / 0,12 10-3 =2,1 104 S m-4. Graphiquement on trouve : (0,63-0,38) / ((29-21) 10-6) =3,1 104 S m-4.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|