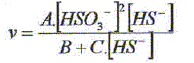|
Cinétique d'une réaction d'oxydation de HS-
par HSO3- :
concours
Caplp maths sciences 2011 |
|||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||
|
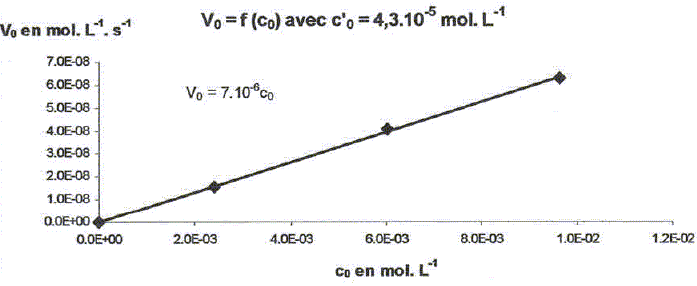
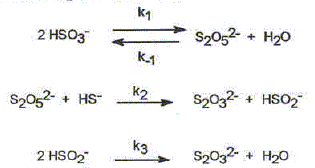
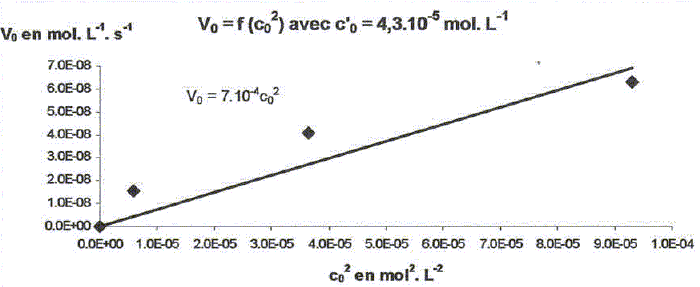
On étudie la cinétique de la réaction suivante : 2HS-aq + 4HSO3-aq = 3S2O32-aq + 3H2O(l). On détermine la vitesse de formation initiale v0 à 20°C des ions thiosulfate pour différentes concentrations molaires initiales de HS-aq notée c0 et HSO3-aq notée c'0. On donne les résultats expérimentaux. 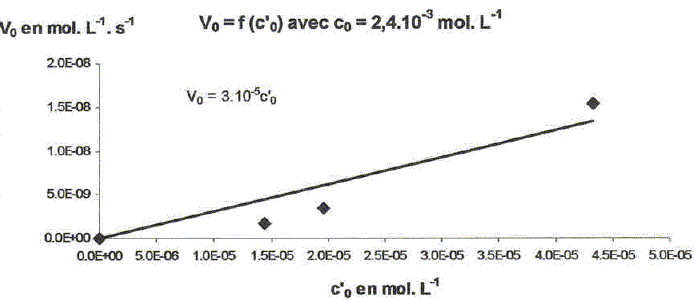 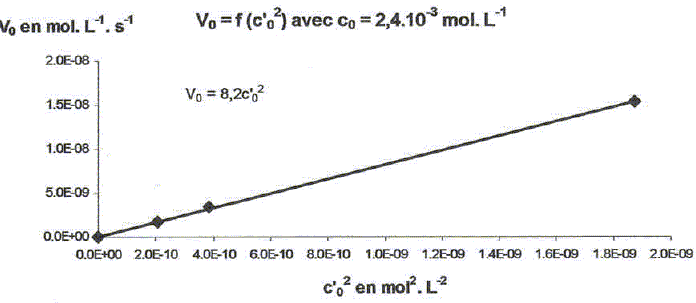
 Définir la vitesse volumique v de formation des ions thiosulfate S2O32-aq. Vitesse de la réaction : v = 1/V dx/dt avec V : volume de la solution et x : avancement (mol).
Décrire une méthode permettant la détermination de la vitesse initiale v0 de formation des ions thiosulfate. Déterminer l'avancement x de la réaction pour différentes valeurs du temps et tracer la courbe x = f(t). Le coefficient directeur de la tangente à l'origine de cette courbe est proportionnel à la vitesse initiale de la réaction au facteur V près. On note a l'ordre partiel par rapport à HS-aq, ß l'ordre partiel par rapport à HSO3-aq et k la constante de vitesse. Montrer que v0 = kc0a c'0ß. [ d[S2O32-aq] /dt]0 = 3v0 = 3kc0a c'0ß. Déterminer a et ß ainsi que l'ordre global de la réaction. c0 étant constante, c'0 varie : [ d[S2O32-aq] /dt]0 =K'c'0ß . avec K' =3kc0a = constante. Le premier graphe d'équation v0 = f(c'0) n'est pas une droite : a est différent de 1. c'0 étant constante, c0 varie : [ d[S2O32-aq] /dt]0 =K''c0a . avec K'' =3kc'0ß = constante. Le 3è graphe d'équation v0 = f(c0) est une droite : ß est égal à 1 D'où : 8,2 = 3k c0 = 3* 2,4 10-3 k ; k = 1,14 103 ~1,1 103 L2mol-2 s-1. et 3kc'02 = 7 10-6 = 3k (4,3 10-5)2 ; k = 1,26 103 ~1,2 103 L2mol-2 s-1. On retient k ~ 1 x103 L2mol-2 s-1 et a = 2 et ß = 1. L'ordre global est égal à 3.
La constante de vitesse k a été déterminée à différentes températures :
Rappeler la loi d'Arrhénius puis déterminer l'énergie d'activation de la réaction. k = pZ exp(-Ea/(RT)) avec p : facteur stérique ; Z : facteur de fréquence et Ea : énergie d'activation positive. ln k = ln(pZ) -Ea/(RT). On trace la droite d'équation ln k = f(1/T ) ; son coefficient directeur vaut -Ea/R avec R = 8,31 J mol-1 K-1. 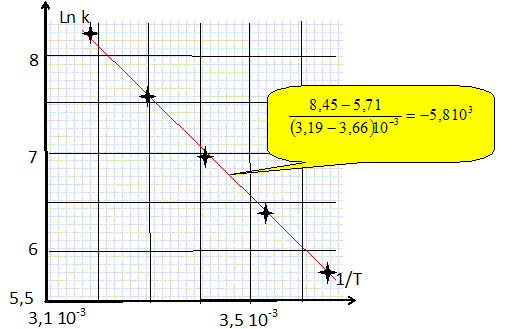 Ea = 5,8 103 *8,31 ~ 48 kJ /mol.
|
|||||||||||||||||||||||||||||||||||||||||||||||||
| |
|||||||||||||||||||||||||||||||||||||||||||||||||
|
|