|
Dosage des ions sulfures en solution
aqueuse :
concours
Caplp maths sciences 2011 |
|||||||
|
|||||||
|
Le protocole de dosage des ions sulfures en solution aqueuse est le suivant : à V1 = 20,0 mL d'une solution de diiode I2 aq à cox = 0,10 mol/L, on ajoute V2 = 20 mL d'une solution d'hydroxyde de sodium à 2 mol/L. On observe une décoloration de la solution. On ajoute alors V3 = 20,0 mL de la solution X contenant les ions sulfure à doser puis on chauffe légèrement pendant 10 min en agitant. Après avoir refroidi, on acidifie la solution par addition d'une solution d'acide sulfurique dilué : la solution se colore. On effectue finalement le dosage du diiode par une solution de thiosulfate de sodium ( 2Na+aq + S2O32-aq ) de concentration molaire cred =0,10 mol/L. Le volume versé à l'équivalence est Véq = 22,4 mL. Il s'agit d'un dosage indirect : les ions sulfure S2-aq sont en défaut par rapport au diiode. Préciser la verrerie utilisée pour prélever V1, V2 et V3. V1 et V3, volumes précis sont mesurés à l'aide d'une pipette jaugée. V2 est moins précis : on le mesure à l'aide d'une éprouvette graduée. La solution de diiode à cox = 0,10 mol/L a étét préparée dans une solution d'iodure de potassium ( K+aq + I-aq ) à 100 g/ L. Pourquoi prépare t-on la solution de diiode dans une solution d'iodure de potassium contenant des ions iodure en large excès devant la quantité de diiode ? Le diiode est peu soluble dans l'eau. En présence d'ion iodure en excès, il se forme le complexe I3-, qui lui est très soluble dans l'eau. Proposer un indicateur coloré permettant de visualiser correctement l'équivalence. En présence d'empois d'amidon le diode donne une teinte violette noire à la solution.
Pourquoi aurait-on pu faire un suivi potentiométrique du dosage ? Préciser les électrodes à utiliser. I2 aq + 2S2O32-aq = 2I-aq + S4O62-aq. Le diagramme E-pH de l'élément soufre ( en trait plein ) et de l'élément iode ( en pointillés ) a été tracé à 25°C pour une concentration en espèces dissoutes égale à 0,1 mol/L en tenant compte des espèces S(s), HSO4-aq, SO42-aq, H2Saq, HS-aq et S2-aq. Identifier chacune des espèces notées par les lettres A à D. 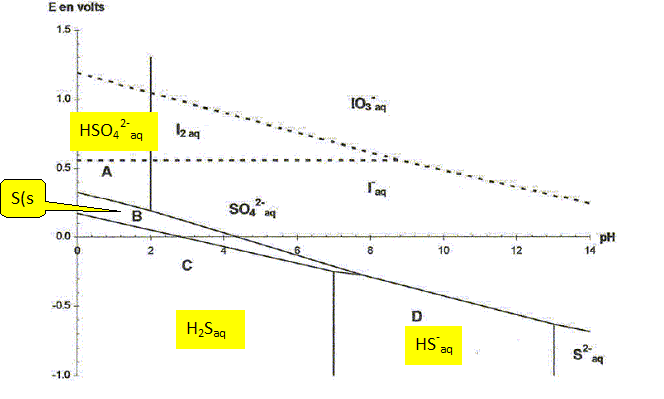 Ecrire la loi de Nernst à 25°C pour le couple redox SO42-aq/ HS-aq puis en déduire le coefficient directeur de la droite frontière dans le diagramme E-pH. On note E1° le potentiel standard du couple considéré. SO42-aq + 9H+aq + 8e- = HS-aq + 4 H2O. E = E1° +0,06 / 8 log ( [SO42-aq][H+aq]9/[HS-aq] ). E = E1° +0,06 / 8 log ( [SO42-aq]/[HS-aq] ) +0,06 / 8 log [H+aq]9. Sur la droite frontière : [SO42-aq]=[HS-aq] ; E = E1° -0,06*9/8 pH.
Le diagramme E-pH de l'élément iode a été tracé pour une concentration en espèces dissoutes égale à 0,01 mol/L en tenant compte des espèces I2 aq, IO3-aq et I-aq. Quand on augmente le ph d'une solution de diiode I2aq, celui-ci se dismute en IO3-aq et I-aq. Ecrire l'équation associée à cette réaction après avoir défini le terme dismutation. Le diiode joue àla fois le rôle de réducteur et d'oxydant. I2 aq , réducteur s'oxyde : I2 aq + 12HO-aq= 2IO3-aq + 10 e- +6H2O. I2 aq , oxydant se réduit : 5I2 aq +10 e- = 10 I-aq. 6I2 aq +12HO-aq= 2IO3-aq +10 I-aq +6H2O. A l'aide des diagrammes E-pH donner les équations des réactions chimiques qui ont lieu : Lors de la décoloration de la solution : le diiode est la seule espèce colorée, il se dismute en milieu basique, la couleur disparaît. 6I2 aq +12HO-aq= 2IO3-aq +10 I-aq +6H2O. Lors du chauffage : oxydation des ions sulfure en ion sulfate : 3 fois { S2-aq +8 HO-aq = SO42-aq + 8e- +4H2O } . Réduction des ions IO3-aq en ion iodure : 4 fois { IO3-aq + 6e- + 3H2O = I-aq + 6 HO-aq }. 3S2-aq + 4IO3-aq = 3SO42-aq + 4I-aq. Lors de la coloration de la solution : en milieu acide IO3-aq et I-aq donnent I2 aq. 2IO3-aq +10 I-aq + 12 H+aq = 6I2 aq +6H2O.
|
|||||||
| |
|||||||
|
|