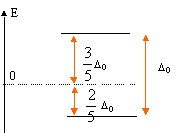|
Etude
de quelques complexes du cobalt :
concours
Capes 2011 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Le cobalt, de par sa structure électronique, est susceptible de former deux types de complexes de géométrie différente. Les spectres d'absorption ont été représentés ci-dessous pour deux d'entre eux : [Co(H2O)6]2+ ( A, lmax = 540 nm) et [CoCl4]2- ( B, lmax = 670 nm). 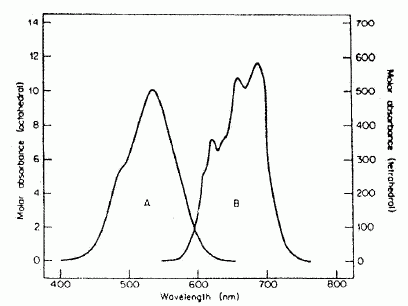 Donner la définition d'un complexe. Un complexe est un édifice constitué de 1 ou plusieurs cations, entouré de plusieurs ligands, molécules ou ions. Ces derniers délocalisent une partie de leur densité électronique sur l'ion central. Quelle est la géométrie du complexe [Co(H2O)6]2+ ? Quelles sont les deux géométrie possibles pour [CoCl4]2- ? Donner la couleur des complexes en justifiant. [Co(H2O)6]2+ : complexe octaèdrique de couleur rose, couleur complémentaire de la couleur absorbée, le vert ( A, lmax = 540 nm). [CoCl4]2- : coordinence 4, le complexe peut être tétraèdrique ou plan carré. Ce complexe absorbe dans le rouge ( B, lmax = 670 nm); la couleur complémentaire du rouge est le cyan. Donner la relation entre l'énergie E d'un photon et la longueur d'onde l associée. En déduire, de ces deux complexes, celui qui présente la transition électronique la plus énergétique. E = h c / l ; à la plus petite longueur d'onde correspond la plus grande transition énergétique. [Co(H2O)6]2+ ( A, lmax = 540 nm) et [CoCl4]2- ( B, lmax = 670 nm) : [Co(H2O)6]2+ présente la plus grande transition énergétique. Les transitions électroniques peuvent être expliquées à l'aide de la théorie du champ cristallin. Donner la structure électronique de l'ion cobalt (II) et de l'atome de cobalt. Z= 27. Atome : 1s2 2s2 2p6 3s2 3p6 4s2 3d7. Ion cobalt II : 1s2 2s2 2p6 3s2 3p6 3d7.
Expliquer la levée de dégénérescence des orbitales d observée pour un complexe de géométrie octaèdrique. Un ligand à champ fort est un ligand pour lequel l'éclatement D0 du champ cristallin est supérieur à l'énergie d'appariement P : le maximum d'électrons sont appariés et le spin est faible. Un ligand à champ faible est un ligand pour lequel l'éclatement D0 du champ cristallin est inférieur à l'énergie d'appariement P : le maximum d'électrons sont célibataires et le spin est fort. 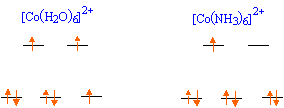 Pour [Co(H2O)6]2+ on observe cinq électrons sur le niveau eg et deux électrons sur le niveau t2g. Donner la définition du champ cristallin D0 pour le complexe A. Comment peut-on déterminer D0 expérimentalement ? Calculer sa valeur ( en eV) pour le complexe A. Champ cristallin : champ électrostatique créé par les ligands entourant l'ion central. Si le complexe reçoit un photon d'énergie E = D0, un électron peut passer du niveau eg au niveau t2g. Si la radiation est située dans le visible, le complexe est coloré. La connaissance de la longueur d'onde de la radiation absorbée permet de connaître D0. E = h c / l = 6,63 10-34 *3,0 108 / 540 10-9 =3,68 10-19 J = 3,68 10-19 /1,6 10-19 eV =2,30 eV. Proposer des hypothèses pouvant expliquer la différence de couleur des deux complexes. La géométrie des complexes est différente ( octaédrique , tétraédrique ). Les ligands sont de nature différente ( molécules d'eau et ion chlorure ). Etude de la corine. La corine est une molécule cyclique : 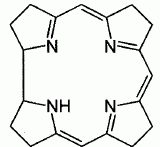 Elle est synthétisée à partir du pyrole C4H5N :  Rappeler les critères d'aromaticité selon Hückel. Une molécule est "aromatique" si la structure est plane et si elle possède 4n+2 ( avec n entier) électrons délocalisés sur un cycle. La molécule de pyrrole est-elle aromatique ? Justifier . Les carbones sont hybridés sp2 ( molécule plane ) ; le doublet de l'azote est conjugué avec les doubles liaisons C=C. Il y a 6 électrons délocalisés sur un cycle plan : le pyrrole est aromatique. Ecrire les formes limites de résonance de la molécule de pyrrole. 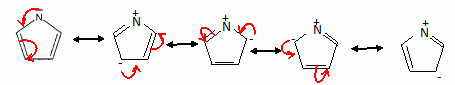
Le doublet non liant de l'atome d'azote est-il nucléophile. Justifier. Le doublet non liant de l'atome d'azote est délocalisé sur le cycle aromatique : il est donc peu disponible ; ce doublet non liant n'est pas nucléophile. La corine est-elle une molécule aromatique ? Justifier. L'anneau est au trois quart aromatique : les atomes de carbone et d'azote sont hybridés sp2, donc structure plane. Il y a 6 doubles liaisons et un doublet non liant de l'azote ( 4 *3+2 = 14 ) délocalisés sur les trois quart de l'anneau. Etude des propriétés complexantes du cobalt vis à vis du dioxygène. Le complexe noté [Co(salen)], où "salen" représente le ligand N, N' -bis(salicylidène) éthylène diammine. A l'état solide, le complexe [Co(salen)] existe sous forme de deux dimères. L'une des formes, de couleur marron, notée A, est active vis à vis du dioxygène et l'autre forme, de couleur rouge, notée I, est quant à elle inactive. 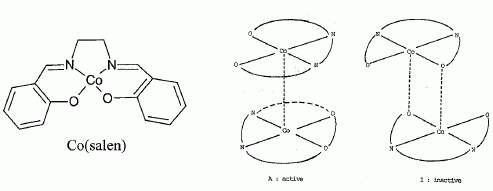 Il va s'agir d'étudier ci-dessous la réaction du [Co(salen)] ( de masse molaire M=325 g/mol ) avec le dioxygène de l'air et de vérifier la stoechiométrie du complexe ponté avec O2 dans l'équation décrite ci-après (1). Protocole expérimental. Une mase m = 0,070 g de [Co(salen)] est mise en solution dans 1 L de DMF, en excès, dans un réacteur relié à un tube gradué rempli d'eau permettant de mesurer la variation de pression due à l'absorption du dioxygène. Le complexe se transforme en sa forme active et va pouvoir réagir avec le dioxygène en excès dans le milieu réactionnel. 2 [Co(salen)] + 2DMF + O2 = [Co2(DMF)2(salen)2O2] (1). 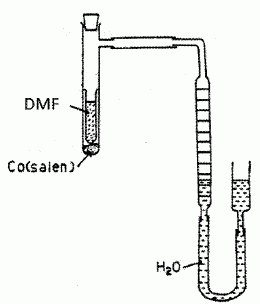
Le volume d'eau est relevé à différents instants afin de suivre la cinétique de la réaction. On obtient le tableau de résultats suivant :
Donner les conditions CNTP. Température : 0°C et P = 1,013 105 Pa. Donner l'expression littérale de la vitesse de réaction. On utilisera les ordres partiels a, ß et g relatifs aux espèces [[Co(salen)]], [DMF] et [O2] v = k' [[Co(salen)]]a [DMF]ß[O2]g. Or le DMF et O2 sont en large excès : [DMF] et [O2] sont à peu près constants. La vitesse peu s'écrire : v = k [[Co(salen)]]a avec k = k'[DMF]ß[O2]g. ( méthode de dégénérescence de l'ordre). On note n(0) et n(t) la quantité de matière en complexe [Co(salen)] respectivement à l'instant initial et à l'instant t, V(0) et V(t), le volume d'eau respectivement à l'instant initial et à l'instant t. Calculer n(0). n(0) = m / M = 0,070/325 =2,1538 10-4 ~2,15 10-4 mol. Donner l'expression de n(t) en fonction de n(0), V(0), V(t) et Vm.
n(t) = n(0) -2x = n(0) -2(V(0)-V(t)) / Vm. Montrer graphiquement que la réaction suit une cinétique d'ordre 1 par rapport au [Co(salen)]. v = 1/V dx/dt avec V = 1 L ; dx/dt = k n(t)aavec a = 1 dans l'hypothèse d'un ordre 1 par rapport au [Co(salen)]. dx/dt = k(n(0)-2x) ; dx/(n(0)-2x) = k dt ; par intégration on trouve : ln(n(0) / (n(0)-2x) = 2kt. On trace le graphe ln(n(0) / (n(0)-2x)) en fonction du temps. On doit trouver une droite de pente 2k si l'hypothèse est vérifiée.
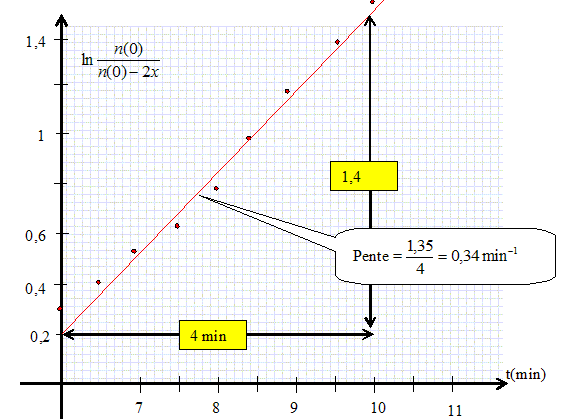 k = 0,34 / 2 = 0,17 min-1. Calculer le rapport entre la quantité de matière totale de dioxygène absorbée et la quantité de matière de complexe introduit à l'aide du tableau de valeur. xf =(V(0) -V(11)) / Vm =8,93 10-5 mol ; xf /n(0) =8,93 10-5 / 2,15 10-4 = 0,42. On attendait la valeur 0,5 compte tenu des coefficients stoechiométriques de la réaction chimique. Le complexe ne s'est pas transformé complètement en sa forme active.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|