|
Etude
de la pile à combustible,
cryoscopie, synthèse de la nitroglycérine, nitrocellulose :
concours
Capes 2011 |
|||||||
|
|||||||
|
La pile à combustible classique à hydrogène est composée de deux électrodes séparées par un électrolyte ( exemple : l'acide phosphorique H3PO4 ). Elle est alimentée en dihydrogène et en dioxygène en continu. On considère qu'elle fonctionne à 269 K. Qui a inventé la première pile électrique ? Préciser l'année et la décrire succinctement. Volta, en 1800, réalise un empilement de disque de cuivre et de zinc séparés parun tissu imbibé de saumure. Cuivre, saumure, zinc, cuivre, saumure, zinc .... Ecrire l'équation de la réaction de fonctionnement de la pile à combustible classique à hydrogène à pH=0. 2H2(g) + O2(g) = 2H2O(l). On considère que la pile fonctionne dans les conditions standard. Donner la définition des conditions standard. Contitions standard : P = 1 bar ; il n'y a pas de température standard. Condition normales de température et de pression P = 1,013 105 Pa et t = 0°C. Déterminer la force électromotrice de cette pile à pH =0. E = E°(O2(g) /H2O) -E°(H+aq /H2(g) = 1,23-0 = 1,23 V. Cette pile a pour combustible H2, espèce gazeuse, difficilement stockable, inflammable. Afin de pouvoir utiliser les piles à combustible dans l'industrie automobile, il a fallu chercher d'autres combustibles.Le méthanol a au départ été choisi pour remplacer le dihydrogène mais l'activité du catalyseur était insuffisante à température ambiante. Un nouveau carburant a été envisagé : une solution aqueuse de borohydrure de sodium. L'ion borohydrure s'hydrolyse dans l'eau en libérant du dihydrogène selon la réaction : BH4-aq +2H2O = 4H2(g) + BO2-aq. Le bore est un semi-métal qui forme des liaison covalente. Donner la définition d'une liaison covalente. Chaque atome lié met en commun un électron externe ; le doublet constitue la liaison covalente. Le bore se trouve à l'état naturel sous plusieurs formes. Quelle est la principale source naturelle du bore ? Borates de sodium hydratés. Nos allons étudier par la suite la pile à combustible à borohydrure direct. le dihydrogène ne figure plus dansl'équation bilan ; l'ion borohydrure et le dioxygène constituent les réactifs de cette pile. La réaction se produit en milieu alcalin,à pH=14. Ecrire les demi-équations électroniques pour chaque couple en milieu basique. E°(BO2-aq / BH4-aq) = -1,24 V à pH=14 ; E°(O2(g) /H2O) =0,39 V à pH=14. BH4-aq +8HO-aq = BO2-aq +8e- +6H2O. 2 fois { O2(g) + 4e- + 2H2O = 4HO-aq }. On considère que la pile fonctionne dans les conditions standard. Quelle demi-pile constitue l'anode ? La cathode ? le pôle positif ? Le pôle négatif ? Justifier. Oxydation de BH4-aq à l'anode négative ; réduction de O2(g) à la cathode positive.
En déduire
l'équation de la réaction de fonctionnement de la pile. Justifier
que cette réaction est thermodynamiquement possible par le calcul de sa
constante d'équilibre. Il va s'agir de déterminer la masse molaire du naphtalène à l'aide du camphre par la technique de cryoscopie. Une solution liquide contient une masse mc = 100 g de camphre et une masse mn =1,00 g de naphtalène. La congélation de ce mélange commence à une température TA = Tfus(camphre) -DT. Constitution de la phase liquide : camphre + naphtalène ; constitution de la phase solide : camphre. Que vaut la fraction molaire du camphre en phase solide ? Le camphre est seul en phase solide, sa fraction molaire vaut xcs=1. Donner l'expression de la fraction molaire du camphre dans la phase liquide, xcL en fonction de mc, mn, Mc et Mn masses molaires respectives du camphre et du naphtalène. Quantités de matière : ncamphre = mc/Mc ; nnapht = mn/Mn ; xcL = ncamphre /( ncamphre+nnapht)=mc Mn / (mc Mn +mnMc ) Donner l'expression du potentiel chimique du camphre en phase solide µs et en phase liquide µL, en fonction des fractions molaires. µs = µ°s +RT ln xcs =µ°s. µL = µ°L +RT ln xcL. Quelle relation existe-t-il entre les potentiels chimiques du camphre en phase liquide et en phase solide à la température de congélaton ? Le liquide étant en équilibre avec le solide, les potentiels chimiques sont égaux à la température de congélation. Quellle relation existe-t-il entre l'enthalpie libre standard de fusion DrG°fus et les potentiels chimiques standard du camphre en phase liquide et solide µ°L et µ°s ? DrG°fus =µ°L -µ°s. En déduire une relation entre DrG°fus et xcL. µs = µL ; µ°s= µ°L +RT ln xcL ; µ°L -µ°s = -RT ln xcL . DrG°fus =µ°L -µ°s = -RT ln xcL . On rappelle la relation de Gibbs-Helmholtz : 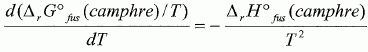 où DrH°fus représente l'enthalpie standard de fusion du camphre. En intégrant cette relation entre TA et Tfus ( camphre) , montrer que : 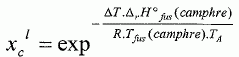 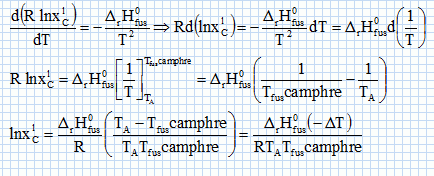 En faisant l'hypothèse que TA~Tfus camphre, on obtient : 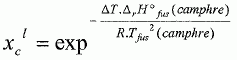 Montrer que DT peut se lettre sous la forme : 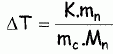 . .Préciser l'expression de K et les approximations faites. On fera l'hypothèse mn << mcMn / Mc. xcL = =mc Mn / (mc Mn +mnMc ) = 1 / (1+mnMc /(mc Mn)) ~1-(mnMc /(mc Mn)) ln xcL ~ -mnMc /(mc Mn). 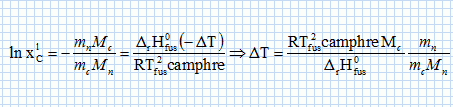 Sachant que K = 37,7 103 K g mol-1 et DT = 2,945°C, calculer la masse molaire du naphtalène. Mn =Kmn /(DT mc) =37,7 103/ 294,5 =128 g/mol.
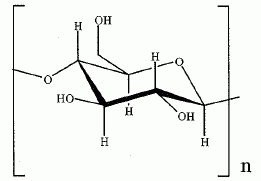
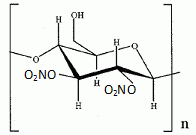
Synthèse de la nitroglycérine. Le camphre permet de stabiliser la nitroglycérine. Avec le temps, le camphre s'évapore et l'explosif devient instable. La nitroglycérine ou 1, 2, 3-tris-nitrooxypropane est obtenue par nitration du glycérol ou propane-1, 2, 3-triol à l'aide d'acide nitrique fumant en présence d'acide sulfurique à 66°Baumé, soit 94 % massique ( densité d = 1,83 ; M = 98 g/mol), à une température ne devant pas dépasser 30°C. Que signifie acide nitrique fumant ? A concentration supérieure à 86%, l'acide nitrique est qualifié "d'acide nitrique fumant". Calculer la concentration molaire de la solution d'acide sulfurique utilisée. Masse d'acide pur dans 1 L : m = 1,83*0,94 =1,72 kg = 1720 g m/M =1720 / 98 = 17,55 ~18 mol dans 1 L. Le réactif de nitration est un mélange d'acide nitrique et d'acide sulfurique dans un rapport (1/2). Par une réaction acido-basique entre ces deux acides, il se forme l'ion nitronium de formule NO2+. Ecrire la réaction de formation de l'ion nitronium. HNO3 + H2SO4 =NO2+ +H2O + HSO4-. Donner la formule de Lewis et la géométrie de l'ion nitronium en justifiant. 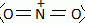 type AX2,
linéaire. type AX2,
linéaire.Donner un exemple de molécule isoélectronique de l'ion nitronium. L'ion nitronium est isoélectronique avec le dioxyde de carbone. La réaction de nitration de la fonction alcool du glycérol peut être modélisée de la façon suivante : ROH(s) + NO2+ --> RONO2 +H+. Proposer un mécanisme pour cette réaction. 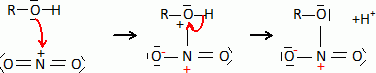 Donner la formule topologique de la nitroglycérine. Les trois fonctions alcool réagissent. 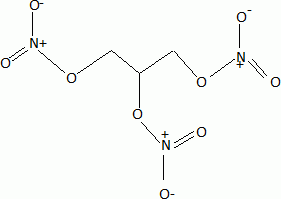 Décomposition de la nitroglycérine stabilisée par le camphre. Lorsque le camphre se sublime, la nitroglycérine explose au moindre choc ou étincelle. La décomposition de la nitroglycérine liquide, de formule brute C3H5O9N3 libère O2(g), N2(g), CO2(g) et H2O(l). Ecrire l'équation bilan de la décomposition d'une mole de nitroglycérine. C3H5O9N3 (l) = 3CO2(g) +2,5 H2O(l) + 1,5 N2(g) +½ O2(g). Exprimer littéralement puis calculer l'enthalpie standard de la réaction à la température T1 = 298 K. DrH°298 =3DfH°(CO2(g) ) + 2,5DfH°(H2O(l)) +1,5 DfH°(N2(g)) +0,5 DfH°(O2(g)) -DfH°(C3H5O9N3 (l)). DrH°298 =3*(-393,5) +2,5 *(-285,8) -(-370,9) = -1524,1 ~ -1524 kJ mol-1. Exprimer littéralement puis calculer l'entropie standard de la réaction à la température T1 = 298 K. DrS°298 =3S°(CO2(g) ) + 2,5S°(H2O(l)) +1,5 S°(N2(g)) +0,5 S°(O2(g)) -S°(C3H5O9N3 (l)). DrS°298 =3*213,8 +2,5 *69,95 +1,5*191,6 +0,5*205,2-545,9 = 660,375 ~660,4 J mol-1K-1. Calculer l'enthalpie libre standard de la réaction à la température T1. DrG°298 =DrH°298 -T1 DrS°298 = -1524,1 -298*0,6604 = -1720,9 kJ mol-1. Calculer la constante thermodynamique de la réaction à la température T1, notée K°(T1). DrG°298 =-RT1 ln K°(T1) ; ln K°(T1) = 1,7209 106 / (8,31*298) =694,9 ; K°(T1) =6,34 10301. L'équilibre est-il déplacé en faveur des réactifs ou des produits ? Justifier. K°(T1) est très grande : l'équilibre est déplacé en faveur des produits ; la réaction est totale dans le sens direct. Cette réaction provoque une augmentation de température et de pression. Expliquer ces hausses. DrH°298 est négative : la réaction est exothermique. Le nombre de moles des produits gazeux augmente de 5 moles à partir d'une mole de nitroglycérine liquide. La pression du mélange gazeux va croître. On réalise désormais l'étude de la décomposition de la nitroglycérine à la température T2 = 320 K. On se place dans les conditions d'Ellingham. Qu'appelle t-on approximation d'Ellingham ? On se place dans le cadre de l'approximation d'Ellingham : DrH° et DrS° ne dépendent pas de la température. Tant qu'il n'y a pas de changement de phase, on linéarise DrG°T =DrH°298 - T Dr S°298. On obtient des fonctions affines par intervalle. Prévoir qualitativement l'évolution de la constante d'équilibre lorsque la température passe de T1 à T2 en justifiant. La réaction étant exothermique, à plus haute température, l'équilibre serait déplacé dans le sens indirect. La constante d'équilibre diminue si la température augmente. Exprimer puis calculer la valeur de la constante thermodynamique d'équilibre à la température T2, notée K°(T2). Ecrire l'équation de Van t'Hoff : ln (K°(T2)/ K°(T1))= DrH°298 / R ( 1/T1-1/T2). ln (K°(T2)/ K°(T1))= -1,524 106 / 8,31 ( 1/298-1/320) = -42,309 ; K°(T2)/ K°(T1) = 4,22 10-19 ; K°(T2)= 4,22 10-19 K°(T1) = 4,22 10-19 * 6,34 10301=2,68 10283.
|
|||||||
| |
|||||||
|
|