|
Etude du dichromate de potassium comme
étalon primaire :
concours
Capes 2011 |
|||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||
|
Le solide K2Cr2O7 se présente sous forme de cristaux orangés et a un degré de pureté compris entre 99,5 et 100%, il peut, par conséquent, être utilisé comme étalon primaire pour déterminer, par exemple la concentration C d'une solution de thiosulfate de sodium. Le thiosulfate de sodium se présente sous la forme de cristaux blancs hydratés de formule Na2S2O3, 5 H2O. Mode opératoire : Une masse m = 0,2207 g de dichromate de potassium, de masse molaire M = 294,2 g/mol, pesée avec précision, est dissoute dans une fiole jaugée de 50,00 mL On note C0 la concentration molaire de la solution ainsi préparée. On introduit dans un erlenmeyer une prise d'essai de la solution de dichromate, V = 10,00 mL, ainsi qu'un excès d'une solution aqueuse d'iodure de potassium et 10,00 mL d'une solution d'acide sulfurique diluée. La solution devient marron brun. On procède alors au dosage du diiode formé en versant la solution aqueuse de thiosulfate de sodium jusqu'à décoloration. On obtient un volume à l'équivalence VE = 11,10 mL. Calculer C0. n(K2Cr2O7) = m / M = 0,2207 / 294,2 =7,5017 10-4 mol. C0 = n(K2Cr2O7) / Volume de la fiole jaugée = 7,5017 10-4 /50,00 10-3 =1,500 10-2 mol/L. Ecrire l'équation de la réaction d'oxydorédution se produisant entre les ions iodure et les ions dichromate. Oxydation de l'ion iodure : 3 fois { 2I-aq = I2aq + 2e- }. Réduction de l'ion dichromate : Cr2O72- aq +14H+aq +6e- = 2Cr3+aq + 7 H2O. Cr2O72- aq +14H+aq +6 I-aq = 2Cr3+aq + 3 I2aq + 7 H2O. En déduire la relation entre les quantités de matière des ions dichromate dosés et du diiode formé. n(Cr2O72- aq) = n( I2aq) / 3.
La molécule de diiode est-elle soluble en solution aqueuse ? Justifier. La réaction doit être rapide et totale. Justifier le fait que la réaction étudiée puisse être une réaction support d'un dosage. E°(I2aq /I-aq ) = 0,62 V ; E°(S4O62-aq /S2O32-aq ) =0,080 V à pH = 0. La différence entre ces deux potentiels est de l'odre de 0,50 V. La constante de réaction sera grande et en conséquence la réaction sera totale. Donner la définition de l'équivalence. A l'équivalence, les quantités de matière des réactifs sont en propottions stoechiométriques. Avant l'équivalence, l'un des réactifs est en excès, après l'équivalence, l'autre ractif est en excès. Donner la relation à l'équivalence entre C0, V, C et VE. calculer C. n(I2aq) =½ n(S2O32-aq) = 3 n(Cr2O72- aq) ½CVE= 3VC0 ; C = 6VC0 / VE = 6*10,00 *0,01500 / 11,10 =8,108 10-2 mol/L. La réaction de dosage a lieu en milieu acide. On se propose d'étudier le diagramme potentiel pH du diiode afin de justifier le choix de ce pH de travail. On se limitera dans cette étude aux espèces suivantes : I2 aq, IO3-aq et I-aq. La concentration de chacune des espèces iodées est égale à 0,10 mol/L sur les frontières. Indiquer les espèces qui prédominent dans les domaines I, II, III. Justifier. Nombre d'oxydation de l'élément iode : dans I-aq : -I ; dans I2 aq : zéro ; dans IO3-aq : +V. I-aq occupe la partie inférieure ; IO3-aq se trouve à la partie supérieure. 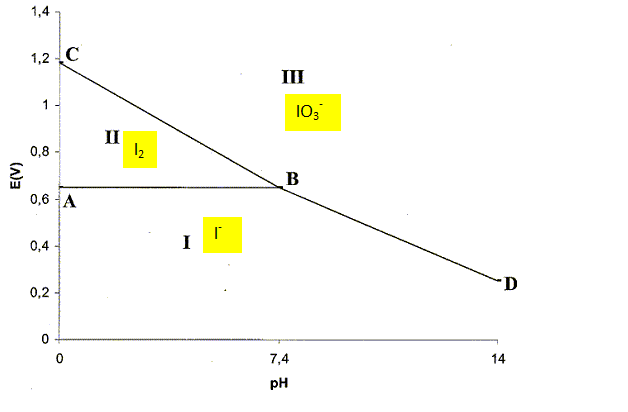
Déterminer les équations des segments AB et BC. E°(IO3-aq /I2 aq ) = 1,19 V. Frontière AB entre I2 aq et I-aq : E1 = E°(I2 aq /I-aq ) +0,03 log [I2 aq] / [I-aq]. Sur la frontière [I2 aq] = [I-aq] d'où : E1 = E°(I2 aq /I-aq ) = 0,62 V. Frontière BC entre I2 aq et IO3-aq : 2IO3-aq +12H+aq +10e- = I2 aq + 6H2O. E2 = E°(IO3-aq /I2 aq ) +0,006 log [IO3-aq]2[H+aq]12 / [ I2 aq]. Sur la frontière [I2 aq] = [IO3-aq]= 0,1 mol/L, d'où : E2 =E°(IO3-aq /I2 aq ) +0,006 log 0,1 +0,006*12 log [H+aq]. E2 =1,19 -0,006-0,072 pH ; E2 =1,184-0,072 pH. Déterminer par le calcul les cordonnées du point B. E= 0,62 V ; 0,62 = 1,184 -0,072 pH soit pH = 7,83. La couleur caractéristique du diiode disparaît lors de l'ajout d'une solution basique. Quelle type de réaction se produit-il ? Ecrire l'équation de cette réaction. Le diiode est la seule espèce colorée, il se dismute en milieu basique, la couleur disparaît. I2 aq , réducteur s'oxyde : I2 aq + 12HO-aq= 2IO3-aq + 10 e- +6H2O. I2 aq , oxydant se réduit : 5I2 aq +10 e- = 10 I-aq. 6I2 aq +12HO-aq= 2IO3-aq +10 I-aq +6H2O. Justifier l'ajout de la solution aqueuse d'acide sulfurique lors de la réaction de dosage par la solution aqueuse de thiosulfate de sodium. En milieu acide IO3-aq et I-aq donnent I2 aq : ce dernier joue le rôle d'oxydant et l'ion thiosulfate joue le rôle de réducteur.
|
|||||||||||||||||||||||||||||
| |
|||||||||||||||||||||||||||||
|
|