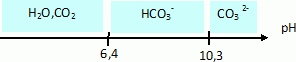La mesure du pH donne pH = 7,8.
La solution est-elle acide, neutre ou basique ?
A 25°C, une solution dont le pH est supérieur à 7 est basique.
Sur un axe gradué en pH placer les domaines de prédominance des espèces acides et basiques des deux couples suivants :
CO2, H2O / HCO3- ; HCO3- / CO32-.
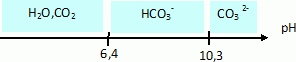
Quelle est l'espèce responsable de l'alcalinité de la piscine ?
A pH=7,8, HCO3- prédomine.
|
|
L'alcalinité est caractérisée par son T.A.C. Le T.A.C d'une eau correspond au
volume ( exprimé en mL ) d'acide chlorhydrique de concentration 2,0 10-2
mol/L en ion oxonium H3O+ nécessaire pour doser
100 mL d'eau, en présence de vert de bromocrésol.
On
prélève un échantillon de volume V = 200 mL que l'on dose par de
l'acide chlorhydrique à 0,02 mol/L. Le volume équivalent est VE = 16,4 mL.
On donne pour l'indicateur coloré :
| Forme acide
|
zone de virage
| Forme basique |
jaune
|
3,8 ; 5,4
| bleu |
Quelle est la couleur de l'indicateur coloré au début du dosage. Justifier.
Avant l'équivalence les ions oxonium sont en défaut et le pH de l'eau
est supérieur à 5,4. L'eau se trouve dans l'erlenmeyer, la couleur de
la solution est donc bleue.
Après l'équivalence, les ions oxonium sont en excès ; le pH est
inférieur à 3,8 : la couleur de la solution est jaune.
Comment repère t-on l'équivalence ?
L'équuivalence est repérée par le changement de couleur de l'indicateur coloré acidobasique.
Déterminer le T.A.C de cette eau.
Pour un échantillon de 100 mL, le volume équivalent serait de : 8,2 mL. T.A.C = 8,2.
Le titre hydrotimétrique français est donné par la relation T.H = 10 c.
c : concentration molaire des cations Ca2+ et Mg2+ exprimée en mmol/L.
L'eau de la piscine possède une concentration massique en ions calcium de 70 mg/L et de 18 mg/L pour les ions magnésium.
Calculer les concentrations molaires de ces ions en mmol/L.
M(Ca) = 40,1 g/mol ; M(Mg) = 24,3 g/mol.
[Ca2+] =0,070 / 40,1 =1,7456 10-3~1,7 10-3mol/L = 1,7 mmol/L.
[Mg2+] =0,018 / 24,3 =7,41 10-4~0,74 10-3mol/L = 0,74 mmol/L.
Calculer la dureté de l'eau et conclure.
[Ca2+] +[Mg2+] = 2,4864 mmol/L ; TH = 10*2,4864= 24,86~ 25.
TH
|
0 à 7
|
7 à 15
|
12 à 25
|
25 à 42
|
>42
|
eau
|
très douce
|
douce
|
moyennement dure
|
dure
|
très dure
|
L'eau est moyennement dure.
|
.
L'eau de Javel.
Les propriétés désinfectantes de l'eau de Javel sont liées au caractère oxydant de l'ion hypochlorite ClO-.
On a choisi d'utiliser une eau de Javel à 2,6 % soit un degré
chlorométrique de 9°. En effet l'eau de Javel dégage un gaz toxique au
contact de l'acide chlorhydrique : le dichlore Cl2(g).
Données : Vm = 24 L / mol.
Le degré chlorométrique de l'eau de Javel est le volume de dichlore
gazeux ( en litre ) que peut libérer un litre d'eau de Javel. Exemple :
le degré chlorométrique de l'eau de Javel commerciale est de 48°, c'est
à dire que 48 L de dichlore peuvent être libérés par 1 L d'eau de
Javel selon la réaction :
ClO-aq + 2H+aq +Cl-aq --> Cl2(g) + H2O (1).
1 ppm : ( parties par million ) : nombre de mL d'une espèce chimique présente dans 1 m3.
Effets du dichlore gazeux en fonction de la concentration exprimée en ppm.
concentration du gaz en ppm
|
effets
|
0,08
|
limite de détection olfactive
|
1 à 3
|
irritation des membranes muqueuses après une heure d'exposition
|
5 à 15
|
irritation modérée des voies respiratoires supérieures
|
10
|
danger immédiat pour la vie et la santé après 10 minutes d'exposition
|
30
|
douleurs immédiates à la poitrine, vomissements et toux |
40 à 60
|
oedème pulmonaire et mort possible
|
>1000
|
mort par suffocation en quelques minutes.
|
Ecrire la demi-équation d'oxydoréduction associée au couple Cl2(g) / Cl-aq.
Oxydation : 2Cl-aq = Cl2(g)+2e-. (2)
Compléter la demi-équation associée au couple ClO-aq / Cl2(g).
Réduction :...ClO-aq+ ...H+aq +...e- = Cl2(g)+2H2O.
Conservation de l'élément chlore : 2ClO-aq+ ...H+aq +...e- = Cl2(g)+2H2O.
Conservation de l'élément oxygène : 2ClO-aq+ ...H+aq +...e- = Cl2(g)+2H2O.
Conservation de l'élément hydrogène : 2ClO-aq+ 4H+aq +...e- = Cl2(g)+2H2O.
Conservation de la charge : 2ClO-aq+ 4H+aq +2e- = Cl2(g)+2H2O.(3)
En ajoutant (2) et (3) on retrouve (1).
2Cl-aq +2ClO-aq+ 4H+aq +2e- = Cl2(g)+2e-+ Cl2(g)+2H2O.
Simplifier : 2Cl-aq +2ClO-aq+ 4H+aq = Cl2(g)+ Cl2(g)+2H2O.
Diviser par deux : Cl-aq + ClO-aq+ 2H+aq = Cl2(g)+H2O.
La concentration molaire des ions hypochlorites est [ClO-aq] =0,375 mol/L.
A partir de (1), calculer la quantité de dichlore gazeux n(Cl2) susceptible d'être dégagé par un volume V = 1 L d'eau de Javel.
n(ClO-aq) = [ClO-aq] V =0,375 mol.
D'après les nombres stoechiométriques de (1) : n(ClO-aq) =n(Cl2) = 0,375 mol.
Vérifier que le degré chlorométrique est 9°.
Volume de dichlore : n(Cl2) Vm = 0,375*24 =9°.
Cette eau de Javel à 9° est vendue par bidon de 5,0 L. Un des bidons est stocké dans un hall de surface S = 250 m2 et de hauteur sous plafond h = 4,0 m.
Calculer ( en mL) le volume de dichlore susceptible d'être dégagé par l'eau de Javel.
5,0 * 9 = 45 L = 4,5 104 mL.
Calculer ( en m3) le volume du hall.
Sh = 250 *4 = 1,0 103 m3.
En déduire la concentration en ppm du dichlore et conclure.
4,5 104 / 1,0 103 = 45 ppm m-3." oedème pulmonaire et mort possible".
|
|