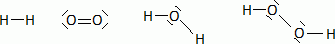|
Autour de l'eau oxygénée : bts chimiste 2011. |
||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||
Calcul d’une énergie de liaison.
|
|
|
étude de la structure d’un solide ionique
L’eau oxygénée peut être également préparée
en traitant du peroxyde de baryum BaO2 par de l’acide sulfurique. Le
peroxyde de baryum est obtenu par action du dioxygène sur l’oxyde de baryum BaO,
solide ionique dont la structure est étudiée ici. Donner la structure
électronique de l’ion Ba2+. 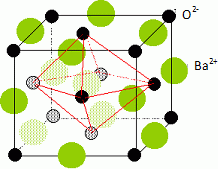 La masse volumique de l’oxyde de
baryum est ρ = |
Etude thermodynamique de la dismutation de l’eau
oxygénée
Vérifier que le
potentiel standard du couple H2O2(aq)/H2O(l)
vaut 1,77 V.
E°(O2(g) / H2O(l)) = 1,23 V. E°(O2(g) / H2O2(aq))= 0,69 V.
(1) ½O2(g) +2H+aq + 2e- = H2O(l) ; DG°1 =-2FE°(O2(g) / H2O(l)).
(2) O2(g) +2H+aq + 2e- = H2O2(aq) ; DG°2 =-2FE°(O2(g) / H2O2(aq)).
(3) H2O2(aq) + 2H+aq + 2e- =2 H2O(l). DG°3 =-2FE°(H2O2(aq)/H2O(l)).
2 fois (1) -(2) donne (3) : -4 FE°(O2(g) / H2O(l)) + 2 FE°(O2(g) / H2O2(aq)) = -2FE°(H2O2(aq)/H2O(l)).
E°(H2O2(aq)/H2O(l)) = 2 E°(O2(g) / H2O(l)) -E°(O2(g) / H2O2(aq)) =2*1,23-0,69 = 1,77 V.
En déduire que, au
moins à pH = 0, l’eau oxygénée se dismute. écrire
l’équation de la réaction de dismutation faisant intervenir une mole de H2O2
et définir la constante de réaction correspondante K°.
E°(O2(g) / H2O(l)) = 1,23 V.
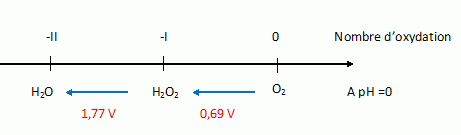
Il y a dismutation d'une espèce si celle-ci est écrite à droite d'une autre espèce avec un potentiel inférieur : (4) H2O2(aq) =½O2(g) + H2O(l).
Calculer K° à 298 K.
de plus DG°4 = -RT ln K° ; ln K° =1,08 F/(RT) = 42. K° =1,7 1018.
|
|
L’eau oxygénée, au laboratoire, peut être
utilisée comme oxydant ou comme réducteur.
Écrire l’équation de la réaction de
l’eau oxygénée avec le permanganate de potassium en présence d’acide sulfurique.
2 fois {
MnO4- + 8H+ +
5e- = Mn2+ + 4H2O
} réduction
5 fois
{H2O2 = O2 +
2H+ + 2e- }
oxydation
2 MnO4- + 5
H2O2 + 6H+ = 5
O2 + 2 Mn2+ + 8H2O.
Écrire l’équation
de la réaction de l’eau oxygénée avec les ions iodure en solution aqueuse.
Proposer un mode opératoire de dosage de l’eau oxygénée utilisant cette
dernière réaction en précisant la préparation de l’échantillon, le choix du
réactif titrant ainsi que le repérage de l’équivalence.
2I- =I2 + 2e-
oxydation
H2O2 +2e-
+2H3O+= 4H2O
réduction
L'équation bilan de la réaction :
H2O2 + 2I-
+2H3O+=
4H2O + I2.
Equation bilan du dosage du diiode formé par le
thiosulfate :
2S2O32- =
S4O62-+2e-
oxydation ; I2+2e-
=2I- réduction
2S2O32- + I2 =
S4O62- + 2I-
d'où n(I2)
=½n(S2O32-).
Indicateur de fin de réaction : en présence de diiode, l'empois d'amidon
donne une couleur violette foncée.
Une eau oxygénée est
dite à « v
volumes », si un litre de cette solution dégage par décomposition complète,
en eau et en dioxygène, v
litres de dioxygène, à
Quantité de matière de dioxygène n(O2) = V / Vm = 110 / 22,4 = 4,91 mol.
H2O2(aq) =½O2(g) + H2O(l).
D'après les coefficients stoechométriques de cette équation n(H2O2(aq)) = 2 n(O2) ==2*4,91 =9,82 mol dans 1 L. [H2O2(aq)] = 9,82 mol/L.
|
|
Etude cinétique de la dismutation de l'eau oxygénée. On considère la réaction de
dismutation de l’eau oxygénée en solution aqueuse : 2 H2O2(aq) --> 2 H2O(l) + O2(g). Les ions Fe3+ catalysent cette réaction.
Montrer que la relation suivante est vérifiée : VO2 / (Voo-VO2) = 2c0kt. 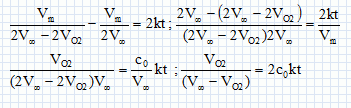 |
Vérifier graphiquement que la réaction est bien d'ordre 2 et en déduire la valeur de la constante de vitesse k.
On trace le graphe VO2/(Voo-VO2) = f(t).
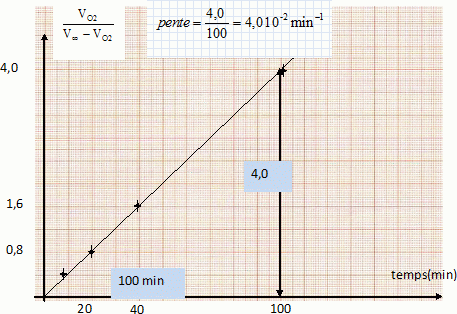
On obtient une droite ( ce qui confirme l'ordre 2 par rapport à H2O2 ) de pente 0,04 = 2 c0 k.
k = 0,04 / (2c0) =0,04 / (2*2) = 0,010 L mol-1 min-1.