Structure d'un édifice covalent.
Ecrire la structure électronique des atomes d'hydrogène, d'oxygène et de chlore.
H ( Z=1) : 1s1 ; O( Z=8) : 1s2 2s2 2p4 ; Cl( Z=17) : 1s2 2s2 2p6 3s2 3p5.
En déduire le schéma de Lewis des molécules d'eau et de chlorure d'hydrogène puis celui de l'ion oxoniumH3O+.
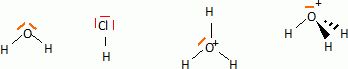
En
déduire par la méthode VSEPR le type et le nom de la géométrie pour la
molécule d'eau et l'ion oxonoim, puis les représenter dans l'espace.
Molécule d'eau : type AX2E2, triangulaire plan.
Ion oxonium : type AX3E, pyramide à base triangulaire.
|
|
Dosage acido-basique.
A 25°C, pKa (CH3COOHaq / CH3COO-aq) = 4,8 ; pKe = 14.
On dose par pHmétrie, un volume VA = 50,0 mL d'un mélange
d'une solution aqueuse d'acide acétique ( ou éthanoïque )
et d'une solution aqueuse d'acide chlorhydrique ( H3O+aq ; Cl-aq ) de concentration molair erespective CAH et CHCl à l'aide d'une solution aqueuse de soude de formule Na+aq + HO-aq de concentration molaire CB =0,500 mol/L. Les résultats du titrage ont permis de tracer la courbe pH = f(VB), VB étant le volume de solution aqueuse de soude ajoutée.
Ecrire les équations chimiques correspondantes aux deux réactions de titrage.
CH3COOHaq + HO-aq = CH3COO-aq +H2O(l)
H3O+aq+ HO-aq =2H2O(l)
Ecrire et calculer les constantes d'équilibre de ces deux réactions. En déduire quel acide est dosé en premier.
K1 =[CH3COO-aq] /([CH3COOHaq][HO-aq]).
Or Ka1 = [CH3COO-aq][H3O+aq] / [CH3COOHaq]
d'où : K1 = Ka1/ ([H3O+aq][HO-aq]) =Ka1/Ke = 10-4,8 / 10-14 = 109,2 ~1,6 109.
K2 =1/ ([H3O+aq][HO-aq])= 1 / Ke = 1014.
K2 est bien supérieur à K1 : l'acide chlorhydrique est dosé en premier.
K2 est très différent de K1 : les deux acides sont dosés successivement.
Déterminer graphiquement les coordonnées des points d'équivalence E1 et E2.
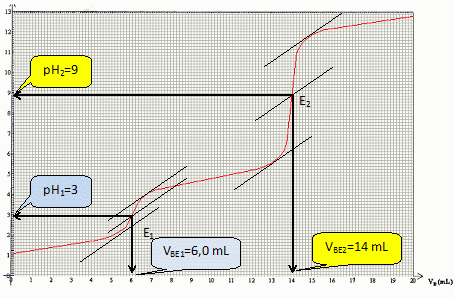
|
Calculer les concentrations molaires des deux acides dans le mélange.
CHCl VA = CB VBE1 ; CHCl = CB VBE1 /VA = 0,500 *6,0 / 50,0 =6,0 10-2 mol/L.
CAH VA = CB (VBE2-VBE1 ) ; CAH = CB (VBE2-VBE1 ) /VA = 0,500 *8,0 / 50,0 =8,0 10-2 mol/L.
Justifier que le volume à la demi équivalence, noté V½, du deuxième dosage est égal à 10 mL. Retrouver graphiquement la valeur du pKa du couple (CH3COOHaq / CH3COO-aq).
V½ = VBE1 + ½(VBE2-VBE1) = ½(VBE2+VBE1) = 0,5( 14+6) = 10 mL.
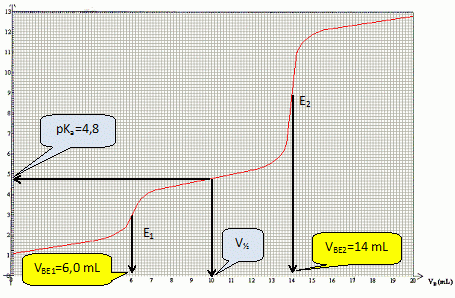
Faire
l'inventaire des espèces chimiques ioniques majoritairement présentes à
la seconde équivalence. Justifier, sans calculs, que le pH soit
supérieur à 7 à cette équivalence.
Cl- aq apporté par l'acide chlorhydrique. Cet ion n'est ni un acide, ni une base.
Na+aq apporté par la solution de soude : c'et ion n'a aucune propriété acidobasique.
CH3COO-aq ion formé lors du dosage de l'acide éthanoïque. Cet ion est une base, base conjuguée de l'acide éthanoïque.
La solution contenant une espèce aux propriétés basiques, aura un pH supérieur à 7.
|
|


