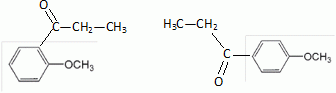|
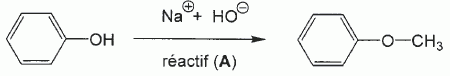
Synthèse de l'anéthol : BTS bioanalyse et contrôles 2011. |
||||||
|
||||||
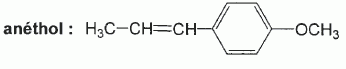
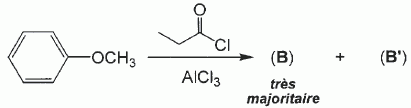
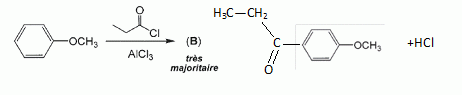 Quel est le rôle du chlorure d'aluminium ? Catalyseur. 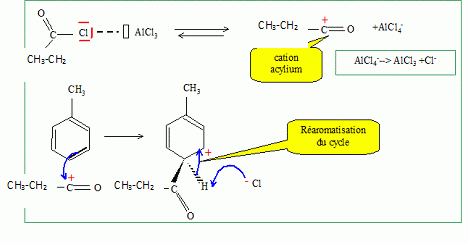 Donner le nom de cette réaction. Acylation de Friedel et Crafts.
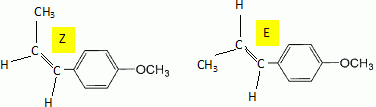
Etape 3. La molécule B est soumise à l'action de dihydrogène gazeux en présence de catalyseur métallique pour conduire au composé C selon le schéma réactionnel donné ci-dessous : 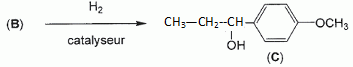 Préciser le type de réaction mise en jeu. Réduction ( Hydrogénation catalytique ) de la fonction cétone en alcool. Entourer les fonctions organiques présentes dans la molécule C. Préciser éventuellement leur classe. 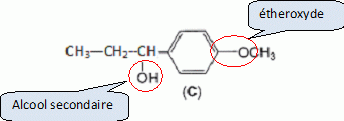 En raison de la présence d'un atome de carbone asymétrique dans la molécule C, cette dernière est obtenue sous forme d'un mélange racémique. Donner la définition d'un mélange racémique. Mélange en proportions égales des énantiomères lévogyre et dextrogyre d'une molécule chirale. Représenter le stéréoisomère de configuration R en explicitant les règles suivies. Numéroter de façon décroissante chacun des quatre substituants selon son numéro atomique. (1) -OH ; (2) cycle ; (3) CH2-CH3 ; (4) H. On place alors l'atome (ou le groupement) de numéro le plus élevé derrière. On regarde dans quel sens, sens horaire ou trigonométrique, on passe du numéro 1, au 2, au 3. - Si le sens de rotation est le sens horaire (ou anti-trigonométrique), le carbone est Rectus (R), - Si le sens de rotation est le sens trigonométrique (ou anti-horaire), le carbone est Sinister (S). 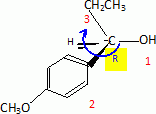
|
||||||
|
|