On
se propose de synthétisé le N-phénylbenzamide C6
H5NHCOC6H5
à l'aide du protocole suivant :
dans un ballon de 100 mL contenant un bareau aimanté, on ajoute 13,0 g
de chlorure de N-phénylammonium C6 H5NH3Cl,
11,7 mL de chlorure de benzoyle C6H5COCl
et suflisamment de toluène afin d'avoir un volume total de 50
mL. Le ballon est équipé d 'un réfrigérant à eau sur lequel est adapté
un dispositif permettant de piéger le gaz libéré lors de la réaction
chimique. Le mélange est porté au reflux à l'aide.d'un agitateur
chauffant et d'un bain d'huile. Après trois heures de chauffage, le
dégagement de chlorure d'hydrogène a cessé. Le mélange est refroidi
puis le toluène est éliminé à l'aide d'un montage de distillation. Le
solide restant dans le ballon est purifié grâce à une recristallisation
en utilisant un mélange éthanol-eau. Le point de fusion du produit pur
est de 162 °C. 11,2 g de produit purifié sont isolés.
D'après S A Shama, T L Tran, Journal
of chemical education, 1978, 816.
Les espèces chimiques ne sont pas en solution aqueuse mais elles sont
solvatées dans un solvant organique.
Recopier
les molécules suivantes et entourer le groupe amide et le groupe acide
carboxylique.
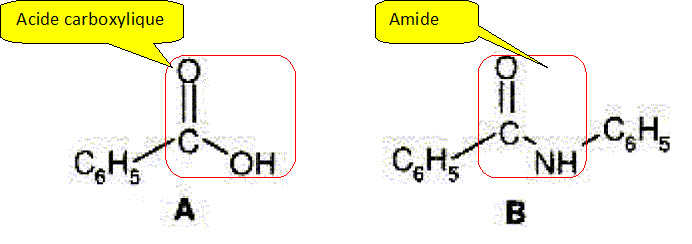
|
Quels sont
les avantages d'un chauffage à reflux ?
En travaillant à température plus élevée,on accélère la réaction
chimique.
On évite les pertes de matière, les vapeurs se condensent
dans le réfrigérant à eau et retombent dans le milieu
réactionnel (ballon ).
|
| espèce
chimique |
solubilité
à chaud
dans le mélange éthanol-eau |
solubilité
à froid
dans le mélange éthanol-eau |
soluilité
dans le toluène |
N-phénylbenzamide
C6 H5NHCOC6H5 |
soluble |
insoluble |
soluble |
chlorure de N-phénylammonium
C6 H5NH3Cl |
soluble |
soluble |
soluble |
acide benzoïque
C6 H5COOH |
soluble |
soluble |
soluble |
Donner le
rôle du toluène en utilisant les données.
Les réactifs et le produit sont tous
solubles dans le solvant, le toluène
Calculer la quantité de matière, notée n1 de
chlorure de benzoyle C6H5COCl.
Chlorure
de benzoyle : masse molaire du M1 =
140,5 g/mol ; masse volumique r
= 1,21 g cm-3.
masse (g) = volume ( mL) * masse volumique ( g cm-3
) ; m1 =11,7 *1,21 =14,157 g ;
n1 = m1
/ M1 =14,157 / 140,5 =0,10076 ~0,100 mol.
Calculer
la quantité de matière, notée n2 de chlorure de
N-phénylammonium C8 H5NH3Cl.
Masse
molaire de C8 H5NH3Cl
: M2 = 129,5 g/mol.
n2 = m2
/ M2 =13,0 / 129,5 =0,10039 ~0,100 mol.
Compléter
le tableau d'avancement et déterminer la valeur de l'avancement maximal
xmax.
équation
de la réaction
|
C8 H5NH3Cl |
+ C6 H5NH3Cl |
= C6 H5NHCOC6H5 |
+2HCl(g)
|
état
du système
|
avancement
(mol)
|
quantités
de matière
(mol)
|
initial
|
0
|
n1
|
n2
|
0
|
0
|
état
final
transformation totale
|
xmax |
n1
-xmax
|
n2
-xmax
|
xmax |
2xmax |
n1-xmax=0
; xmax = n1=
0,100 mol.
n2-xmax=0
; xmax = n2=
0,100
mol.
Trouver la
masse maximale de N-phénylbenzamide C6 H5NHCOC6H5
qu'il est possible d'obtenir
et en déduire le rendement de la transformation chimique .
Masse
molaire de la N-phénylbenzamide : M =12*6 +5+14+1+12+16+6*12+5 =197
g/mol ;
m = M xmax
=
197*0,100 = 19,7
g.
Rendement = masse réelle obtenue / masse maximale théorique =11,2 /
19,7 = 0,57 ( 57
%).
|
Le
solide restant dans le ballon, avant la purification par
recristallisation, est composé d'un mélange de N-phénylbenzamide, de
chlorure de N-phénylammonium et d'acide benzoïque.
Expliquer le principe de la
recristallisation.
La
N-phénylbenzamide, le chlorure
de N-phénylammonium et l'acide benzoïque sont solubles à chaud dans le
mélange de solvants éthanol-eau.
On dissout le solide, à chaud dans le volume minimal de
solvant éthanol-eau.
Puis on laisse refroidir : à
froid les impuretés, le chlorure
de N-phénylammonium et l'acide benzoïque sont toujours solubles dans le
solvant éthanol-eau. Par contre le N-phénylbenzamide
est insoluble : il cristallise au cours du refroidissement. On peut
l'isoler par filtration.
Le
point de fusion permet de connaître la pureté d'une espèce chimique. A la fin de la recristallisation, la
température de fusion mesurée pour le produit est de 162 °C.
Conclure
sur la pureté en utilisant le texte en début du sujet.
Le point de fusion du produit pur est
de 162 °C. Le point de fusion mesurée est 162°C : le produit
est donc pur.
Citer une
autre méthode permettant d'estimer la pureté d'un produit de synthèse.
La chromatographie sur couche mince.
.
|
|
