Le
salipran est un médicament di antalgique utilisé notamment contre la
douleur. Le principe actif est le bénorilate. ce composé est un ester
obtenu à partir de l'aspirine et du paracétamol.
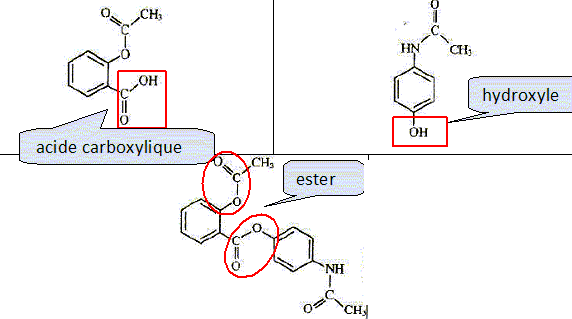
| nom | paracétamol | aspirine | bénorilate | acide salicylique | | formule topolgique | 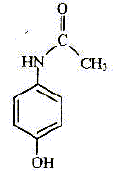 | 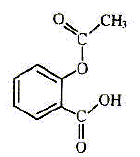 | 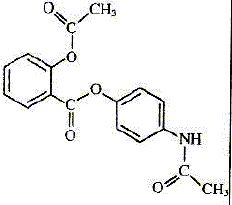 | 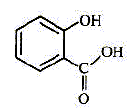 | | formule brute | C8H9O2N | C9H8O4 | C17H15O5N | C7H6O3 | | masse molaire ( g/mol ) | 151 | 180 | 313 | 138 | | propriété | antalgique | antalgique | di antalgique | antalgique |
Entourer
le groupe hydroxyle dans la formule du paracétamol, le groupe qui
caractérise la fonction acide carboxylique dans la formule de
l'aspirine, les groupements qui caractérisent les deux fonctions esters
dans la formule du bénorilate.
Synthèse du bénorilate.
D'après le texe, le bénorilate est obtenu à partir du paracétamol et de l'aspirine..
Quel est le nom de la transformtion chimique mise en jeu ?
Estérification.
Enoncer
les lois de conservation qui permettent d'écrire l'équation d'une
réaction nucléaire.
Conservation de la charge et conservation du nombre de nucléons.
Ecrire
l'équation de la réaction mise en jeu en utilisant les formules brutes.
C8H9O2N + C9H8O4 = C17H15O5N + H2O.
.Mode opératoire de la synthèse :
Dans un ballon contenant 100 mL d'une solution hydroalcoolique ( mélange 50 % en volume d'eau et d'éthanol ), on introduit m1 = 18,0 g d'aspirine et m2
= 15,1 g de paracétamol et n y ajoute quelques gouttes d'acide
sulfurique concenté. On chauffe à reflux pendant 30 minutes. Après ce
chauffage, on sépare le bénorilate et on le purifie par une méthode
appropriée. Après séchage, on obtient une masse m de bénorilate égale à
18,8 g.
Parmi
les deux schémas fournis, annoter le montage correspondant au chauffage
à reflux. Y indiquer le sens de circulation de l'eau dans l'élément de
verrerie repéré par la flèche. 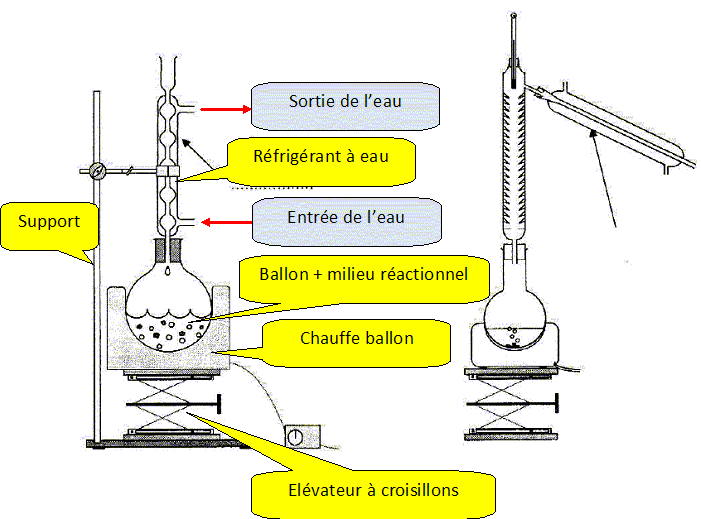
Pourquoi faut-il chaufer ? Pourquoi le reflux
?
En travaillant à température modérée, plus élevée, on augmente la vitesse de la réaction.
Les
vapeurs se condensent dans le réfrigérant à eau et retombent dans le
milieu réactionnel : on évite ainsi les pertes de matière.
Quel est le rôle de l'acide sulfurique ?
L'acide sulfurique joue le rôle de catalyseur.
Calculer
les quantités de matière initiales des réactifs et montrer que le
mélange initial de paracétamol et d'aspirine est stoechiométrique.
Quantité de matière (mol) = masse (g) / masse molaire ( g/mol)
Paracétamol : m2 / 151 = 15,1 / 151 = 0,100 mol.
Aspirine : m1 / 180 = 18,0 / 180 = 0,100 mol.
D'après
les nombres stoechiométriques de l'équation, une mole d'aspirine réagit
avec une mole de paracétamol ( ou 0,1 mol d'aspirine réagit avec 0,1
mol de paracétamol).
Les réactifs sont donc en proportions stoechiométriques.
Calculer le rendement de la synthèse.
On peut espérer btenir au mieux 0,100 mol de bénorilate soit une masse mthéorique = 0,100 *313 = 31,3 g
Rendement : masse réelle / masse théorique = 18,8 / 31,3 = 0,601 ( 60,1 %).
|
Assimilation par l'oganisme :
Après
ingestion d'un comprimé de salipran, le bénorilate subit une hydrolyse
acide des fonctions ester au niveau de l'estomac. Cette hydrolyse
libère deux nouveaux principes actifs représentés dans le tableau en
début d'exercice.
Quelles sont les deux molécules aux propriétés antalgiques obtenues après hydrolyse acide ?
Justifier le qualificatif " di antalgique".
L'aspirine et le paracétamol, libérés au niveau de l'estomac, possèdent toutes deux des propriétés antalgiques..
|
|