|
Le sulfate de calcium, un substitut de l'os , l'acide lactique, indice de fraicheur d'un lait : bac STL biochimie, génie biologique 2011. |
|||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||
|
Etude des atomes contenus dans l’ion sulfate SO42-. Donner les configurations électroniques (s, p, d…) des atomes de soufre et d’oxygène pris dans leur état fondamental, en appliquant les règles de remplissage des sous-couches électroniques. O : 1s2 2s2 2p4 ; S : 1s2 2s2 2p6 3s2 2p4 ; Déduire des configurations électroniques de l’oxygène et du soufre leur position dans la classification périodique. Colonne n° 16 ; l'oxygène appartient à la deuxième période et le soufre à la troisième période. L’oxygène est présent dans certains composés sous la forme d’ions O2-. Donner la configuration électronique de cet ion. Proposer une explication quant à la tendance à la formation de l’ion O2-. L'atome d'oxygéne, en gagnant deux électrons, donne l'ion oxyde O2- dont la couche électronique externe est complète (1s2 2s2 2p6 ).
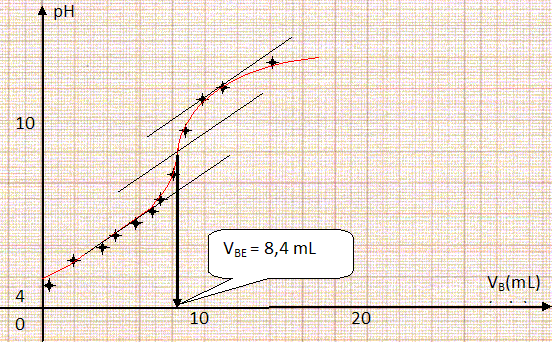
La solution est-elle saturée en sulfate de calcium ? Justifier. La mase m est inférieure à la solubilité s : la solution n'est donc pas saturée. Déterminer les concentrations molaires en ions sulfate et calcium dans la solution ainsi obtenue. n = m / MCaSO4 = 0,500 / 136,2 =3,67 10-3 mol dans 1 L. [Ca2+aq]=[SO42-aq] = 3,67 10-3 mol / L. Pour saturer la solution en sulfate de calcium, on dispose de sulfate de calcium hémihydraté de formule brute CaSO4,½H2O. Cette solution sera utilisée par le chirurgien pour fabriquer sa pate. Déterminer la quantité de matière, notée n, correspondant à 500 mg de sulfate de calcium hémihydraté. M = 136,2 +0,5(16+2) =145,2 g/mol ; n = m / M = 0,500 / 145,2 =3,44 10-3 mol / L. Vérifier que le volume d’eau maximal à ajouter à la quantité de matière, n, calculée précédemment est V = 702 mL. Pour cela chercher une relation entre s, V et n. [Ca2+aq]=[SO42-aq] = n / V ; s =[Ca2+aq] MCaSO4 = n MCaSO4 / V ; V = n MCaSO4 / s = 3,4435 10-3 *136,2 / 0,66724 =0,703 L = 703 mL.
L'acide lactique, indice de fraicheur d'un lait. Dans l’industrie agroalimentaire, on contrôle l’état de fraîcheur d’un lait en mesurant son acidité totale en équivalent d’acide lactique. En effet, un lait frais ne contient pas d’acide lactique. Les bactéries lactiques présentes dans le lait provoquent, au cours du temps, la transformation d’une partie du lactose en acide lactique. Le lait devient alors de plus en plus acide jusqu’à « tourner ». Conventionnellement, l’acidité du lait s’exprime dans l’industrie en degré Dornic (°D) : 1°D correspond à 0,10 g d’acide lactique dans le lait. Un lait frais présente une acidité Dornic inférieure à 18°D. L’acide lactique. L’acide lactique a pour formule semi-développée CH3-CHOH-COOH. Nommer les fonctions présentes dans cette molécule. 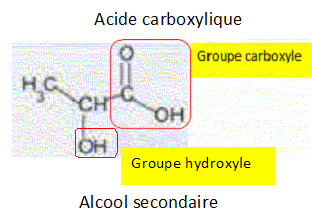 Dans la suite de l’exercice, on note R-COOH l’acide lactique.
|
|||||||||||||||||||||||||||||||||||||||||||||
|
|