|
Hydrométallurgie du zinc, dosage du cuivre dans un laiton : bac STL chimie de laboratoire 2011. |
|||||||
|
|||||||
|
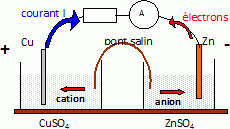
Après plusieurs étapes de traitement de la blende, on obtient une solution aqueuse S contenant des ions Zn2+ et des traces d’ions Cu2+. Les concentrations molaires sont égales à 2,3 mol.L-1 pour les ions Zn2+ et 1,6 x 10-2 mol.L-1 pour les ions Cu2+ dans la solution S. L’objectif est d’éliminer les ions cuivre(II) de la solution S. Étude d’une pile. Dans un bécher 1, on place un volume V1 = 100 mL d’une solution S1 de sulfate de cuivre(II) de concentration molaire c1 = 1,6 x 10-2 mol.L-1. Dans un bécher 2, on place un volume V2 = 100 mL d’une solution S2 de sulfate de zinc de concentration molaire c2 = 2,3 mol.L-1. Étude de la demi-pile 1. On plonge une lame de cuivre dans le bécher 1. Donner l’expression littérale du potentiel E1 de l’électrode de cuivre plongeant dans la solution S1. Calculer le potentiel de cette électrode. E1 = E°(Cu2+aq/Cu(s)) + 0,03 log [Cu2+aq] =0,34 +0,03 log 1,6 x 10-2 = 0,286 ~0,29 V. Étude de la demi-pile 2. Donner l’expression littérale du potentiel E2 de l’électrode de zinc plongeant dans la solution S2. Calculer le potentiel de cette électrode. E2 = E°(Zn2+aq/Zn(s)) + 0,03 log [Zn2+aq] = -0,76 +0,03 log 2,3= -0,749 ~ -0,75 V.
Écrire l’équation de la réaction modélisant la transformation qui se produit dans la pile lorsqu’elle débite. Zn(s) + Cu2+aq = Cu(s) + Zn2+aq. Donner l’expression de la constante d’équilibre K de la réaction mise en jeu en fonction des concentrations des différentes espèces à l’équilibre. K = [Zn2+aq]éq / [Cu2+aq]éq Établir l’expression de la constante d’équilibre K en fonction des potentiels standard des couples mis en jeu ; vérifier que cette constante est voisine de 5 x 1036. A l'équilibre E1 = E2 : E°(Cu2+aq/Cu(s)) + 0,03 log [Cu2+aq] = E°(Zn2+aq/Zn(s)) + 0,03 log [Zn2+aq] E°(Cu2+aq/Cu(s))-E°(Zn2+aq/Zn(s)) = 0,03 log([Zn2+aq] / [Cu2+aq]) ( E°(Cu2+aq/Cu(s))-E°(Zn2+aq/Zn(s)) ) / 0,03 = ln K. log K =(0,34 +0,76)/0,03 =36,67 ; K = 4,6 1036. Exprimer et calculer le quotient de réaction Qr,i en début de fonctionnement. En déduire le sens d’évolution du système constitué par la pile. Qr,i = [Zn2+aq]i / [Cu2+aq]i =2,3 / 1,6 10-2 =1,4 102. Qr,i < K, donc évolution spontanée dans le sens direct. Calculer la concentration en ions cuivre(II) dans le bécher 1 quand la pile s’arrête de fonctionner (on considèrera que la concentration dans le bécher 2 reste sensiblement égale à c2 tout au long de la transformation). K = [Zn2+aq]éq / [Cu2+aq]éq = c2 / [Cu2+aq]éq ; [Cu2+aq]éq = c2 / K = 2,3 / 4,6 1036 =5 10-37 mol/L. La cémentation. La cémentation consiste à disperser de la poudre de zinc dans la solution S contenant des ions Cu2+ et Zn2+. Après plusieurs heures de contact, la solution est filtrée. Expliquer l’intérêt de cette opération de cémentation. Le zinc solide est oxydé en ion zinc(II), tandis que les ions cuivre (II) sont réduits en cuivre solide ; ces derniers se déposent au fond de la solution. D'après le calcul précédent, pratiquement tous les ions cuivre (II) sont éliminés de la solution.
Dosage du cuivre dans un laiton. Le laiton est un alliage constitué de cuivre et de zinc. Sa teneur en cuivre est comprise entre 95 % et 55 %, en masse. La teneur en cuivre dans un laiton peut être déterminée par spectrophotométrie d’absorption du complexe [Cu(NH3)4]2+. Dans un premier temps, le laiton est attaqué par une solution d’acide nitrique. Après neutralisation et dilution, on obtient une solution contenant des ions cuivre(II). Les ions cuivre(II) sont ensuite complexés par l’ammoniac, à l’aide d’une solution tampon ammoniacale. Attaque du laiton. Écrire l’équation de la réaction d’oxydation du cuivre avec les ions nitrate de la solution d’acide nitrique (les demi-équations d’oxydo-réduction sont demandées). L'ion nitrate, en milieu acide constitue l'oxydant le plus fort ; le zinc et le cuivre sont des réducteurs capables d'être oxydés par cet ion nitrate. 2NO3- + 8H+ + 6 e- = 2 NO + 4 H2O réduction 3Zn = 3Zn2+ + 6 e- oxydation 3Cu = 3Cu2+ + 6 e- oxydation 2NO3- + 8H+ +3Zn = 3Zn2+ +2 NO + 4 H2O (2) ou 8(NO3- + H+ ) +3Zn = 3(Zn2+ + 2NO3- )+2 NO + 4 H2O (2) 2NO3- + 8H+ +3Cu = 3Cu2+ +2 NO + 4 H2O (1 ) ou 8(NO3- + H+ ) +3Cu = 3(Cu2+ + 2NO3- )+2 NO + 4 H2O (1) Étude d’une solution tampon. On désire préparer V=500,0 mL d’une solution tampon de pH égal à 9,2 par dissolution d’une masse m de chlorure d’ammonium solide dans une solution d’ammoniac à 2,0 mol.L-1 (la dissolution s’effectue sans variation de volume). Rappeler les propriétés d’une solution tampon. Une solution tampon modère les variations de pH suite à l'ajout modéré d'un acide fort ou d'une base forte. Le pH d'un solution tampon ne varie pas suite à une dilution modérée. Calculer la concentration en ions ammonium dans la solution tampon à pH = 9,2. Le pKa du couple (NH4+ / NH3) est égl à 9,2. A pH=pKa, la quantité de matière d'ammoniac est égale à celle d'ion ammonium. [NH4+]=2,0 mol/L. Calculer la masse m de chlorure d’ammonium solide à dissoudre. En solution l'ammoniac réagit partiellement avec l'eau ; on peut considérer que les ion ammonium proviennent exclusivement du chlorure d'ammonium dissout. n = [NH4+] V = 2,0 *0,500 = 1,0 mol ; m = n MNH4Cl = 1,0*53,5 = 53,5 g.
On traite une masse de 1,4 g d’un laiton. Après attaque par la solution d’acide nitrique et complexation par le tampon ammoniacal, on obtient 200,0 mL de solution : la courbe d’étalonnage obtenue par spectrophotométrie d’absorption donne une concentration en complexe [Cu(NH3)4] 2+ dans cette solution égale à 8,0 x 10-2 mol.L-1. Calculer la masse de cuivre contenue dans l’échantillon de laiton traité. nCu = n([Cu(NH3)4] 2+) = 0,200*8,0 x 10-2 =0,016 mol ; mCu = nCu MCu =0,016*63,5 =1,016 ~1,02 g. Déterminer alors le pourcentage massique en métal cuivre dans le laiton étudié ; vérifier que ce résultat est conforme avec les indications de l’énoncé sur la teneur générale en cuivre d’un laiton. 1,016/1,4 *100 =72,6 % ~73 %, valeur comprise entre 55 et 95 %. Le résultat est en accord avec l'énoncé. |
|||||||
|
|