Le
sel régénérant est utilisé dans le lave-vaisselle pour éviter les
traces blanches sur la vaisselle. Il contient majoritairement du
chlorure de sodium.
On veut connaître la masse exacte de chlorure de sodium dans un
échantillon de 1,0 g de produit.
Pour ce faire, on dissout 1,0 g de sel régénérant dans 1,0 L d'eau
dstillée. On obtient la solution S.
On réalise un titrage par précipitation des ion chlorure dans la
solution S. On effectue un suivi conductimétrique.
|
|
Les réactions.
Ecrire l'équation de la réaction de dissolution du chlorure de sodium dans l'eau.
NaCl(s) = Na+aq + Cl-aq.
Ecrire l'équation de la réaction de précipitation des ions chlorure par les ions argent.
Cl-aq + Ag+aq = AgCl(s).
Connaissant le produit de solubilité Ks = 1,6 10-10 du chlorure d'argent, calculer la solubilité s = [Ag+aq] en mol/L puis en g/L.
Ks = [Ag+aq] [Cl-aq] ; la solution est électriquement neutre [Ag+aq] =[Cl-aq] = s.
Par suite Ks = s2 ; s = Ks½ = (1,6 10-10)½ =1,265 10-5 ~1,3 10-5 mol/L.
M(AgCl) =107,9 +35,5 =143,4 g/mol.
s = 1,265 10-5 *143,4 = 1,814 10-3 g/ L= 1,8 mg/L.
En déduire la masse maximale de précipité qui pourrait se dissoudre dans un mélange réactionnel de 200 mL.
1,814 10-3 * 0,2 = 3,6 10-4 g.
La démarche expérimentale.
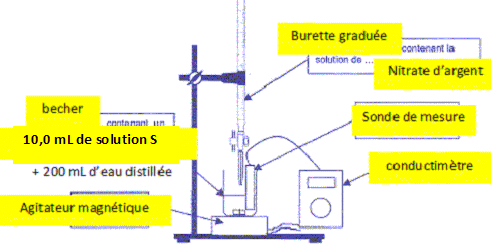
On verse V0
= 10,0 mL de lasolution S dans un becher puis on ajoute un grand volume
d'eau distillée. On installe le conductimètre et une burette contenant
la solution aqueuse de nitrate d'argent de concentration C =2,0 10-2 mol/L.
Faire un schéma légendé du dispositif expérimental.
|
Donner deux raisons qui justifient l'ajout d'eau distillée aux 10,0 mL de solution initiale.
La sonde du conductimètre doit être immergée sur une hauteur voisine de 5 cm.
Le volume de la solution titrée sera considéré comme à peu près constant au cours du dosage.
La conductivité de la solution est proportionnelle à la concentration des ions si la concentrtaion est faible.
Exploitation des mesures conductimétriques.
On
donne le graphe donnant laconductance G=f(V) représentant la
conductance G de la solution en fonction du volume V de nitrate
d'argent versé.
Déterminer graphiquement le volume VE de nitrate d'argent versé à l'équivalence.
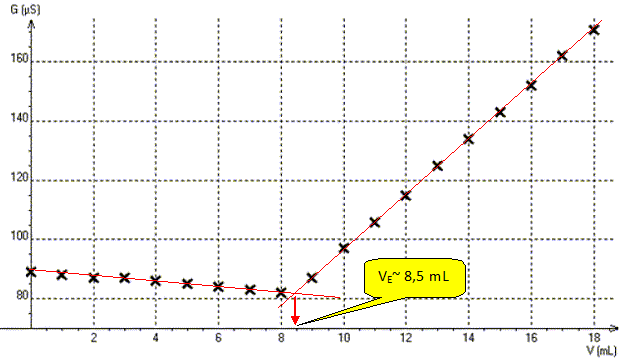
Déterminer la concentration molaire C0 en ion chlorure de la solution S.
A l'équivalence les quantités de matière des réactifs sont en proportions stoechiométriques.
C0V0 = C VE ; C0 = C VE / V0 =2,0 10-2 *8,5 / 10 = 1,7 10-2 mol/L.
En déduire la masse m de chlorure de sodium dans 1,0 L de la solution S.
M(NaCl) = 23+35,5 = 58,5 g/mol ; m = C0 M(NaCl)=0,017*58,5 =0,9945 ~0,99 g/L.
0,99 g de chlorure de sodium dans 1,0 g de sel régénérant. Ce sel est du chlorure de sodium presque pur.
Interprétation de l'allure de la courbe.
Donner la relation entre la conductance G mesurée et la conductivité s de la solution en précisant ls unités.
Conductance G ( siemens S) et conductivité s ( S m-1) sont proportionnelles. G = k s avec k une constante exprimée en mètre.
On donne l°(Cl-) =7,63 10-3 S m2 mol-1 ; l°(Ag+) =6,19 10-3 S m2 mol-1 ; l°(NO3-) =7,14 10-3 S m2 mol-1.
Expliquer qualitativement :
- la diminution de la conductance G avant l'équivalence.
L'ion
argent est en défaut avant l'quivalence ; du point de vue de la
conductivité, tout revient à remplacer l'ion chlorure par l'ion nitrate
de conductivité molaire ionique un peu plus faible.
La conductivité, et en conséquence la conductance de la solution diminue lentement.
- l'augmentation de la conductance G après l'équivalence.
L'ion
argent est en excès après l'équivalence. On ajoute des ions argent et
nitrate à la solution. La conductivité de la solution va croître assez
vite.
|
|

