|
Ester : bac ST2S France 2011. |
|||||||
|
|||||||
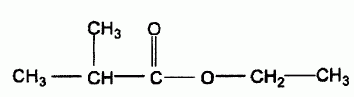 C'est un ester obtenu par réaction entre un alcool A et l'acide 2-méthylpropanoïque, représenté ci-dessous : 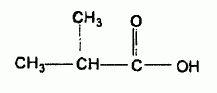
Estérification. Quelles sont les deux caractéristiques de la réaction de synthèse d'un ester ? L'estérification est lente, limitée par la réaction inverse, l'hydrolyse de l'ester.
Pour réaliser la synthèse de l'ester au laboratoire, on réalise le montage suivant : 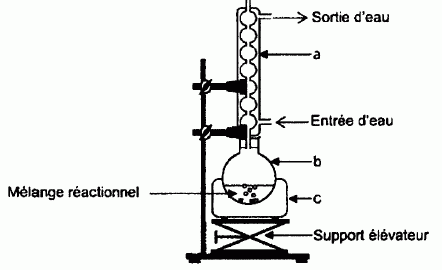 On chauffe pendant 30 minutes un mélange de : - 0,2 mol d'acide 2-méthylpropanoïque et 0,2 mol d'alcool A - quelques gouttes d'acide sulfurique concentré, - quelques grains de pierre ponce. Nommer les éléments a, b et c du montage. a : réfrigérant à eau ; b : ballon ; c : chauffe ballon. Pourquoi chauffe t-on le mélange réactionnel ? En travaillant à température plus élevée, on accélère la réaction chimique. L'équation chimique de la synthèse est la suivante : 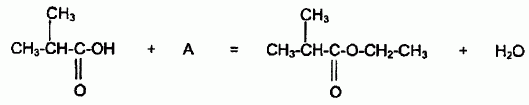
|
|||||||
|
|