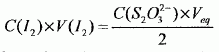|
Saponification
; dosage d'oxydoréduction :
bac ST2S Nlle Calédonie 2010 |
|||||||
|
|||||||
|
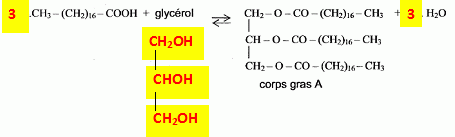
Connu et utilisé avant l'ère chrétienne, le savon étatit à l'origine une mixture obtenue à partir de cendres et de suif ( graisse animale ). A la fin du XVIIe siècle, l'industrie marseillaise importait des matières premières de tout le bassin méditerranéen. Pour répondre à une demande croissante, on mit au point un procédé de fabrication qui employait des corps gras végétaux ( ou graisses végétales) à la place de corps gras animaux. La cendre, provenant de matière végétale marine, contient de l'hydroxyde de sodium NaOH. celle, provenant de matière végétale terrestre, contient de l'hydroxyde de potassium KOH. Ces deux espèces chimiques sont des bases. Donner la définition d'une base selon Brönsted. Une base est une espèce, ion ou molécule, susceptible de gagner un proton H+. Par dissolution des deux espèces chimiques NaOH et KOH dans l'eau, on obtient l'ion HO-. Donner le nom de cet ion et montrer qu'il se comporte comme une base. L'ion hydroxyde peut gagner un proton selon : HO- + H+ = H2O. L'ion hydroxyde se comporte comme une base. Le suif contient un triglycéride, corps gras noté A, obtenu à partir de l'acide octadécanoïque de formule semi-développée CH3-(CH2)16-COOH et du glycérol ou propan-1, 2, 3-triol. Expliquer pourquoi l'acide octadécanoïque est saturé. Cet acide possède une chaîne carbonée comptant n =17 atomes de carbone. La chaîne est dite " saturée" si elle compte 2n+1 =17*2+1 =25 atomes d'hydrogène. CH3-(CH2)16 : 3 + 16*2 = 35 atomes d'hydrogène : l'acide octadécanoïque est donc saturé. Expliquer le sufixe " triol dans l'appellation propan-1, 2, 3-triol. "triol" signifie trois "ol " : le glycérol possède trois fonctions alcool. Recopier et compléter l'équation de la réaction ci-dessous en indiquant la formule semi-développée du glycérol et en ajustant les nombres stoechiométriques.
A quelle famille chimique appartient la molécule organique A obtenue ?
Une solution pharmaceutique contient du diiode I2. Elle est utilisée comme antiseptique sur les plaies, les brûlures, les mycoses car le diiode est un oxydant qui agit en tuant les microorganismes par des réactions d'oxydoréduction. Cette solution commerciale de concentration c0 est trop concentrée pour être directement dosée. Il convient de la diluer 10 fois. On dose le diiode présent dans la solution diluée par des ions thiosulfate S2O32- contenus dans une solution de thiosulfate de sodium de concentration C( L'équation de la réaction est la suivante : I2 +2 On dose un volume V(I2) =10,0 mL. L'équivalence est obtenue pour un volume de solution de thiosulfate de sodium versé Véq =13,0 mL. Pour chaque question, indiquer si la proposition a), b), ou c) est exacte sachant qu'il n'y a qu'une seule bonne réponse par question. a) I2. Vrai. b) I-; c) Analyse : I2 + 2e- = 2I-. I2 gagne des électrons, il joue le rôle d'oxydant. a) capter un proton H+. b) capter un électron. a) I2 / b) I-/ Analyse : I2 + 2e- = 2I-. Le couple oxydant / réducteur est I2 / I-. On écrit l'oxydant le premier. S2O32- a) une perte d'électrons. b) un gain d'électrons. Analyse : 2S2O32- =S4O62- + 2e- . S2O32- perd des électrons, il s'oxyde. a) une éprouvette graduée. b) une pipette jaugée.
|
|||||||
| |
|||||||
|
|