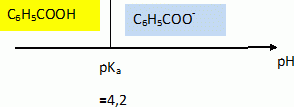|
Un conservateur alimentaire dans un soda : bac S Liban 2011. |
||||||||||||||||||||||
|
||||||||||||||||||||||
|
« Les conservateurs limitent, ralentissent ou stoppent la croissance des microorganismes (bactéries, levures, moisissures) présents ou susceptibles d’entrer dans l’aliment et préviennent donc l’altération des produits ou les intoxications alimentaires. L’acide benzoïque, par exemple, et ses sels de calcium, de sodium et de potassium sont utilisés comme antibactériens et antifongiques dans les denrées alimentaires ». D’après le site www.eufic.org L’acide benzoïque est un conservateur qui figure dans de nombreuses boissons sans alcool, comme les sodas. Son code européen est E210. La formule de l’acide benzoïque est C6H5 – COOH ou encore 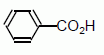 Données : - l’acide benzoïque est un solide blanc à température ordinaire. - masse molaire de l’acide benzoïque : M = 122 g.mol-1. - pKa du couple acide benzoïque / ion benzoate : pKa (C6H5 – COOH / C6H5 – COO-) = 4,2
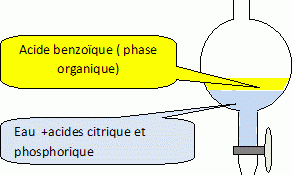
- le toluène et l’eau ne sont pas miscibles. - l’acide phosphorique et l’acide citrique sont solubles dans l’eau. Extraction de l’acide benzoïque. On souhaite connaître la quantité d’acide benzoïque présente dans une boisson au cola en réalisant un titrage acido-basique. En dehors de l’acide benzoïque, la boisson contient également de l’acide phosphorique et de l’acide citrique, ainsi que de l’eau. Il s’agit donc, dans un premier temps, de séparer l’acide benzoïque, que l’on souhaite titrer, des autres acides. Dans un bécher on place un volume V = 100 mL de boisson et on laisse sous agitation magnétique pendant une heure afin d’éliminer le dioxyde de carbone dissous. On ajoute alors environ 100 mL de toluène dans le bécher On verse ensuite le mélange dans une ampoule à décanter.
On
élimine la phase aqueuse. On ajoute un excès de solution aqueuse
d’hydroxyde de sodium dans l’ampoule à décanter contenant la phase
organique puis on agite. Justifier l’apparition des cristaux blancs.
Préparation d’une solution d’acide benzoïque On désire connaître la quantité d’acide pur C6H5COOH présent dans les cristaux récupérés. Après lavage et séchage, on pèse les cristaux ; leur masse est m = 0,38 g. On prépare alors une solution S0 par dissolution de la totalité des cristaux dans de l’eau distillée afin d’obtenir V0 = 250,0 mL de solution. Écrire l’équation de la réaction chimique entre l’acide benzoïque et l’eau. C6H5COOH aq + H2O(l) = C6H5COO-aq + H3O+aq. Exprimer la constante d’équilibre associée à cette équation, puis la calculer. Ka = [C6H5COO-aq] [H3O+aq] / [C6H5COOH aq] = 10-4,2 =6,3 105.
En déduire la masse m0 d’acide pur correspondant. m0 = C0 M( acide benzoïque) =8,6 10-3 *122 =1,0492 ~1,0 g/L. Soit dans 250 mL : 1,0492 / 4 =0,2623 ~ 0,26 g. Déterminer le pourcentage d’acide benzoïque pur contenu dans les cristaux extraits de la boisson au cola. m0 / m*100 = 0,2623 / 0,38 *100 = 69 %. |
||||||||||||||||||||||
|
|