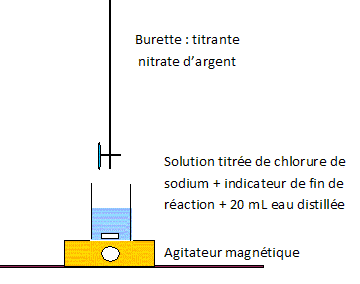
|
Le sel dans les larmes artificielles : bac S France 09 / 2011. |
||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||
|
Composition d'une dose : chlorure de sodium 0,045 g ; eau purifiée 5,0 mL. Solution de chlorure de sodium à 0,9 % en masse. Données : équation de la réaction chimique de dissolution du chlorure de sodium dans l'eau : NaCl(s) = Na+aq + Cl-aq. A température ambiante, la dissolution est totale aux concentrations utilisées. M(Na) = 23 g/mol ; M(Cl) = 35,5 g/mol. Titrage des ions chlorure par réaction avec les ions argent. On introduit dans un erlenmeyer : 5,0 mL de larmes artificielles ( une dose ) ; 20 mL d'eau distillée ; 4 gouttes d'une solution de chromate de potassium, indicateur de fin de réaction. On remplit une burette graduée avec une solution de nitrate d'argent ( Ag+ +NO3- ) de concentration c0 = 5,00 10-2 mol/L. On verse progressivement cette solution de nitrate d'argent dans l'erlenleyer tout en agitant le mélange. La réaction entre les ions chlorure et les ions argent conduit à la formation d'un précipité blanc. L'équation de cette réaction correspondant au titrage est : Ag+aq + Cl-aq = AgCl(s). A partir d'un volume VE = 15,5 mL, l'indicateur de fin de réaction donne un précipité rouge brique indiquant l'équivalence.
On dispose de dix solutions aqueuses de chlorure de sodium de différentes concentrations molaires c pour lesquelles on a mesuré la conductivité s.
Décrire le protocole détaillé permettant de préparer 50 mL de solution N°1 à partir de la solution n°5 supposée en quantité suffisante. Facteur de dilution 5,0 / 1,0 = 5. Volume de solution mère à prélever = volume de la solution fille / facteur de dilutin = 50 / 5 = 10 mL. Prélever 10 mL de solution mère à la pipette jaugée ; placer dans la fiole jaugée de 50 mL. Rincer la pipette à l'eau distillée et verser dans la fiole jaugée. Compléter la fiole jaugée avec de l'eau distillée jusqu'au trait de jauge. Boucher et agiter pour rendre homogène.
On peut modéliser l'évolution des conductivités des solutions par une droite d'équation s = kC dans le domaine étudié. Dans le cas de solutions diluées, exprimer la conductivité s d'une solution aqueuse de chlorure de sodium en fonction des concentrations et des cnductivités molaires ioniques de chaque espèce chimique présente en solution. s = lCl-[Cl-aq] + lNa+[Na+aq]. Sachant que la dissolution du chlorure de sodium dans l'eau est totale, montrer que l'expression précédente est en accord avec l'écriture s=kC. La solution est électriquement neutre : [Cl-aq] = [Na+aq] = C. s = lCl-C + lNa+C = (lCl- + lNa+) C avec (lCl- + lNa+) constant à une température donnée. Déterminer la concentration molaire C dans la solution S. On donne lCl- = 7,3 10-3 S m2 mol-1; lNa+ =5,0 10-3 S m2 mol-1 et 0,880 mS cm-1= 0,088 S m-1. Remarque : k =7,3 10-3 +5,0 10-3 = 12,3 10-3 S m2 mol-1. C = s / k = 0,088 /12,3 10-3 ~ 7,2 mol m-3 ~ 7,2 10-3 mol/L~7,2 mmol/L. Méthode graphique : 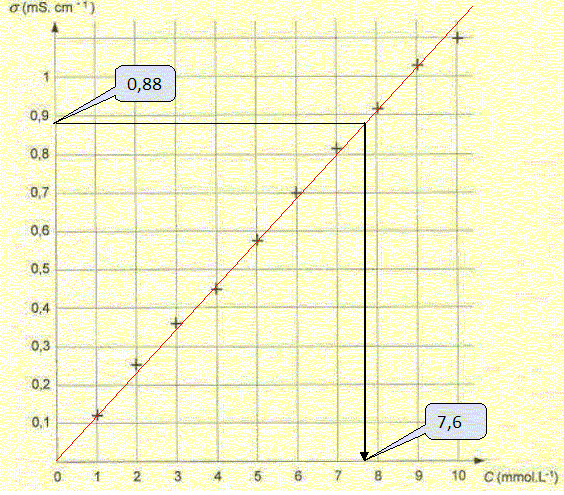
|
||||||||||||||||||||||||||||||||||||||||
|
|