La pile au citron
Une expérience simple à réaliser chez soi :
alimenter un cadran d'horloge, comme l'écran à cristaux liquide d'un
réveil de
voyage, avec un citron !
Matériel
nécessaire pour réaliser la pile :
- Pièces anciennes
en cuivre
- Trombones
galvanisés (entièrement
recouverts de zinc)
- Fils électriques
;- Plusieurs citrons ; Un
multimètre.
L'objectif
de cet exercice est d'expliquer scientifiquement le phénomène.
Données :
• M(Zn)
= 65,4 g.mol-1 ;
• Constante
de Faraday : F = 96500 C.mol-1
• couples
oxydant / réducteur : Zn2+(aq)
/ Zn(s) ; H+(aq) / H2(g).
Polarité de la pile
On
désire mesurer la tension à vide aux bornes de « la pile au citron
».
Pour ce faire, on a réalisé le montage suivant : l'indication
donnée par le voltmètre est : + 0,84 V.

Quel autre nom
donne-t-on à la tension à vide d'une pile ?
La force électromotrice de la pile, notée E, exprimée en volt.
Déterminer
la polarité de la pile au
niveau de la pièce et du trombone. Justifier votre réponse.
Le
trombone recouvert de zinc est relié à la borne COM du multimètre
utilisé en voltmètre. La valeur lue est positive. Le zinc constitue la
borne négative de la pile.
La pièce de cuivre constitue la borne positive de la pile.
|
Principe
de fonctionnement de la pile
Au
cours de son utilisation on constate une effervescence au niveau de
la pièce ancienne. Après analyse du gaz, on en déduit qu'il
s'agit de dihydrogène.
Comment peut-on
mettre en évidence
expérimentalement la présence de dihydrogène ?
Recueillir le dihydrogène dans un tube à essai. Présenter une allumette
enflammée au dessus du tube. On entend une petite détonation.
|
Ecrire les équations
des réactions
d'oxydoréduction ayant lieu à chaque électrode en précisant le type de
réaction
(oxydation ou réduction) et le nom de chaque électrode.
A la cathode positive( cuivre), réduction de l'ion H+aq en
dihydrogène : 2H+aq + 2e-
= H2(g).
A l'anode négative ( zinc), oxydation du zinc : Zn(s) = Zn2+aq
+ 2e-.
En
déduire l'équation de la réaction globale
se produisant au cours du fonctionnement de cette pile.
2H+aq + Zn(s) = Zn2+aq +H2(g).
D'où
proviennent les ions H+(aq)
présents dans les réactifs ?
Le jus de citron contient de l'acide citrique. L'acide citrique réagit
avec l'eau et donne des ions H+aq.
Parmi
les solutions aqueuses telles que le
vinaigre, l'eau sucrée et le jus d'orange, justifier celle(s) qui
aurai(en)t pu
remplacer le citron ?
Le jus d'orange peut contenir des acides ; le vinaigre contient de
l'acide éthanoïque : jus d'orange et vinaigre peuvent convenir.
Comment peut-on
obtenir, avec le matériel
disponible, un dispositif délivrant une tension à vide deux fois plus
grande ?
En
associant deux piles au citron en série, on mesure une tension à vide
deux fois plus grande.
Etude
quantitative
La pile
est utilisée pour faire fonctionner
une horloge pendant une durée Dt = 5 min 30 s.
L'intensité I du courant débité par la pile est égale à 10 mA.
Quelle quantité
d'électricité Q est débitée par la pile pendant la
durée Dt ?
Q = I Dt avec I = 0,010 A et
Dt = 5*60+30 = 330 s.
Q = 0,01*330 = 3,3 C.
Déterminer n, la quantité de
matière de zinc consommée au cours du fonctionnement de la pile.
Justifier.
Quantité de lmatière d'électron n(e-) = Q /F = 3,3
/96500 =3,4197 10-5 mol.
Or Zn(s) = Zn2+aq + 2e-
d'où n = ½n(e-) =1,7098 10-5
~ 1,7 10-5 mol.
En déduire la
variation de masse Dm du trombone pendant
la durée de fonctionnement Dt.
Le métal zinc est oxydé, sa masse diminue : Dm = -n M(Zn) = -1,7098
10-5 *65,4 = -1,1 10-3 g = -1,1 mg.
Cuivrer
un objet en fer
Une autre expérience simple à
réaliser chez soi : cuivrer un objet en fer, soit encore déposer du
cuivre sur
un objet en fer.
Matériel nécessaire pour
réaliser le dépôt :
- Bouillie
bordelaise en poudre, en vente dans les jardineries
- Eau
déminéralisée
- Un
objet à cuivrer : une clé en fer
- Un
petit objet en cuivre
- Une
cuve ; - 2
fils électriques ; - Une
pile de 4,5 V.
Données :
M(Cu) = 63,5 g.mol-1
;
M(S) = 32,1 g.mol-1
;
M(O) = 16,0 g.mol-1.
Préparation
de l'électrolyte
On
trouve du sulfate de cuivre CuSO4 dans « la bouillie
bordelaise »,
poudre très connue des jardiniers qui l'utilisent comme fongicide
(produit
conçu pour tuer ou limiter le développement des
champignons parasites des végétaux). Sur
un paquet de «bouillie bordelaise» acheté en jardinerie, on peut lire
«contient
80 % en masse de CuSO4 ».
Déterminer la masse
notée m de bouillie bordelaise à prélever dans
un paquet pour préparer un volume V =
250 mL de solution aqueuse de sulfate de cuivre de concentration
molaire
apportée C = 1,0 mol.L-1. Cette solution servira d'électrolyte.
Quantité de matière de solide, le sulfate de cuivre, soluté apporté : n
=CV =1,0 *0,25 = 0,25 mol.
Masse molaire du sulfate de cuivre M = 63,5 +32,1 +4*16 =159,6 g/mol.
masse = n M = 0,25*159,6 =39,9 g.
Tenir compte du pourcentage massique : m = 39,9 / 0,80 ~50 g.
Indiquer le
protocole expérimental pour
préparer l’électrolyte à l'aide du matériel que l'on peut trouver dans
les
laboratoires de chimie d'un lycée.
Placer une coupelle sur une balance électronique ; appuyer sur
tare et éventuellement sur zéro.
Prélever le solide à l'aide d'une spatule et peser 50 g de solide.
Placer un entonnoir sur une fiole jaugée de 250 mL ; verser le solide,
rincer entonnoir et coupelle à l'eau distillée.
Remplir la fiole jaugée au 2/3 d'eau distillée et agiter jusqu'à
dissolution complète du solide.
Compléter avec de l'eau distillée jusqu'au trait de jauge. Boucher et
agiter pour rendre homogène.
|
|
Cuivrage
par une transformation spontanée
En plongeant la clé en fer
dans l'électrolyte
préparée, elle se recouvre instantanément d'une mince couche de cuivre
Cu.
Les couples intervenant
au cours de la transformation sont Cu2+(aq) / Cu(s) et Fe2+(aq) / Fe(s).
Ecrire l'équation de la réaction qui
modélise
la transformation se produisant dans le mélange réactionnel. Préciser
l'espèce
jouant le rôle d'oxydant et celle jouant le rôle de réducteur.
Réduction de l'ion Cu2+aq, l'oxydant, en cuivre solide qui
se dépose sur l'objet en fer.
Cu2+aq + 2e- = Cu(s).
Oxydation du réducteur, le fer : Fe(s) = Fe2+aq + 2e-.
Cu2+aq + Fe(s) = Cu(s) + Fe2+aq .
Calculer le quotient de réaction
initial Qr,i et justifier le
caractère spontané de cette transformation ; la constante
d'équilibre de la
réaction vaut K = 1026.
Q r i =[Fe2+aq]iniital / [Cu2+aq]initial =0 / 1
= 0.
Q r i étant inférieur à K,
le système évolue spontanément dans le sens direct.
La présence de cuivre à la surface de la
clé
interrompt la réaction, le dépôt de cuivre sur la clé est donc très
mince,
proposer une
explication pour rendre compte de ce phénomène.
Les atomes de fer ne sont plus en contact
avec les ions Cu2+aq de l'électrolyte.
|
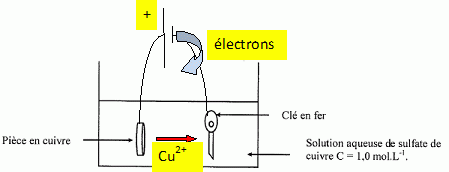
Cuivrage
par une transformation forcée
Afin d'augmenter le dépôt de cuivre sur la
clé, on réalise une électrolyse à anode soluble.
Pour ce faire, on plonge l'objet en cuivre et
la clé dans l'électrolyte préparé ( puis on les relie
convenablement à la pile de 4,5 V
avec deux fils électriques.
Le seul couple mis en jeu au cours de
l'électrolyse est celui relatif au cuivre Cu2+(aq) / Cu(s).
Sur quelle électrode
doit se faire le dépôt
de cuivre ? Écrire l'équation de la réaction à cette électrode.
Le dépot de cuivre doit se faire sur l'objet en fer. Une réduction de
l'ion Cu2+aq se produit à la cathode négative.
Cu2+aq + 2e- = Cu(s) cathode,
clé.
En déduire
l'équation de la réaction à
l'autre électrode et montrer que le bilan de l'électrolyse est :
Cu2+(aq)
+ Cu(s)pièces = Cu(s)clé + Cu2+(aq).
Oxydation
du métal cuivre de l'anode positive : Cu(s) anode,
pièce =Cu2+aq + 2e- .
Par suite : Cu2+(aq)
+ Cu(s)anode, pièce = Cu(s) cathode, clé + Cu2+(aq).
Sur
le schéma du montage,
placer les fils électriques et la pile de 4,5 V en précisant sa
polarité pour
un montage correct et le déplacement des charges lors de l'électrolyse.