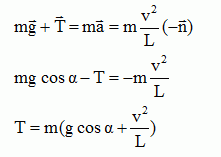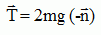Equilibre
d'un solide.
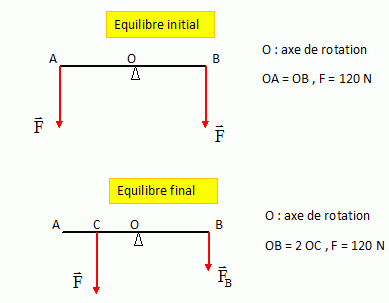
Calcul de
la norme ( valeur) de FB.
Action de F :
rotation dans le sens anti-horaire, bras de levier OC, norme F= 120 N
Moment de cette force par rapport à O : F x OC
Action de F1 :
rotation dans le sens horaire, bras de levier OB, norme F1.
Moment de cette force par rapport à O : -F1 x OB.
A l'équilibre : F x OC-F1 x OB= 0
F x OC-F1 x 2 OC= 0 ; F-2F1 =0 ; F1 =½F = 120/2 = 60 N.
Levier.
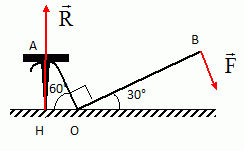
F = 200 N ; OA = 10 cm ; OB = 70 cm ;
Calculer la norme ( en N) de R. ( 200 ; 1400 ; 1617 ; 3234 ; 2800)
A l'équilibre OH * R =OB * F avec OH = 10 cos60 = 5 cm
R = OB*F / OH = 70*200/5 =2800 N.
|
Pendule.
La masse du fil est négligeable ; les frottements sont négligés. La
vitesse initiale est nulle. l'angle a0
initial vaut 60° ; oOn note L la longueur OA=OB ; n est un vecteur
unitaire.
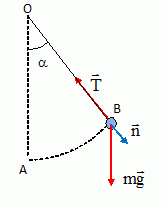
Expression
de la tension du fil T :
Ecrire la seconde loi de Newton dans un repère lié à B ( base de
Frenet) :
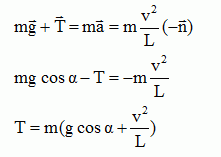
|
Ecrire le théorème
de l'énergie cinétique entre le point de départ M0 et A :
En M0 : vitesse initiale nulle ; altitude L(1-cos a0) ;
en A : altitude nulle, choisie comme origine ; vitesse notée v.
Seul le poids travaille, T est perpendiculaire à la vitesse ; en
descente le travail du poids est moteur : W = mg L(1-cos a0)
DEc =Ec
fin -Ec départ = ½mv2-0 ;
½mv2=mg L(1-cos a0) ; v2=2g L(1-cos a0) ou v2/ L =2g (1-cos a0)
repport dans
l'expression de T ci-dessus :
T = m [ g cos a +2g (1-cos a0) ]
En A : a = 0 d'où T = m [ g +2g (1-cos a0) ]
or cos a0 = cos 60 = 0,5 d'où
T = 2mg.
La tension du fil en A a pour expression : 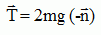
Bobine
inductive de résistance négligeable, d'inductance L =2 H.
Tension U aux bornes de la bobine : u = 6 t ( le temps t est en seconde)
L'intensité initiale i(t=0) est nulle.
Expression
de l'intensité i(t) à une date t.
Expression de la tension aux bornes de la bobine : u(t) = L di/dt = 6t
di/dt = 6t / L = 6t / 2 = 3t ; di = 3t dt
Intégrer entre 0 et t : i(t) = 1,5 t2.
i(t=2 s) = 6 A.
pH d'une
solution.
nom
|
concentration
C (mol/L)
|
pKa
|
HCN
|
0,01
|
9,3
|
HF
|
0,01
|
3,2
|
HCl
|
0,1
|
0
|
HBr
|
0,1
|
-8
|
HI
|
0,1
|
-10
|
Dans quel(s) cas le
pH est-il supérieur ou égal à 2 ?
HCl, HBr et HI sont des acides forts : pH = -log C = -log 0,1 = 1.
HF et HCN sont des acides faibles : pH est supérieur à -log C, c'est à
dire supérieur à -log0,01 =2.
|
Oxydoréduction.
Dans 1 L d'une solution (Fe2+aq + SO42-aq)
telle que [Fe2+aq]= 0,1 mol/L on ajoute m = 1 g de cuivre
métallique.
Fe : 56 ; Cu =: 63,5 g/mol.
Calcul de la masse
de fer solide obtenue :
couple oxydant / réducteur : Cu2+aq/ Cu(s) : E° = 0,34 V ; Fe2+aq/ Fe(s) : E° = -0,44 V ;
E° (Fe2+aq/ Fe(s) ) est inférieur à E° (Cu2+aq/ Cu(s) ), le fer est le réducteur le plus fort
et l'ion Cu2+aq est l'oxydant le plus
fort.
La réaction spontanée qui se produit est donc : Fe(s) + Cu2+aq = Cu(s) + Fe2+aq.
En ajoutant du fer dans une solution de sulfate de cuivre, on observe
un dépôt de cuivre sur le fer et l'oxydation du fer.
En ajoutant du cuivre dans une solution de sulfate de fer, il ne se
passe rien.
|
|