|
Elément
calcium : dosage des ions calcium et magnésium : concours Mines
2010 |
|||||||
|
|||||||
|
Le calcium est un élément relativement abondant tant dans l’écorce terrestre que dans les êtres vivants. Dans un premier temps nous allons nous intéresser aux propriétés chimiques de l’élément et à son abondance, pour ensuite étudier une technique de dosage des ions calcium dans une eau. Abondance et propriétés de l'élément calcium. Donner les configurations électroniques, dans leur état fondamental, de l’atome de calcium Ca et de l’ion calcium Ca2+ auquel il peut mener. Numéro atomique du calcium Z = 20. L'atome de calcium : 1s2 2s2 2p6 3s2 3p6 4s2. L'ion calcium Ca2+ : 1s2 2s2 2p6 3s2 3p6. Dans quelle colonne de la classification périodique se trouve l’élément calcium ? Quel nom portent les éléments de cette famille chimique ? L'élément calcium appartient à la seconde colonne, famille des alcalino-terreux. Dans un cristallisoir rempli d’eau à laquelle on a ajouté quelques gouttes de phénolphtaléine, on dépose un petit morceau de calcium métallique. Le métal réagit vivement avec l’eau et la solution contenue dans le cristallisoir rosit. On admet que la réaction s’accompagne d’un dégagement de dihydrogène gazeux. Quelle est la nature (acide, neutre ou basique) de la solution finale ? Justifier votre réponse. La zone de virage de la phénolphtaléine est [ 8; 10]. Cet indicateur coloré est rose si le pH pH supérieur à 10. La solution finale est basique. Montrer que la transformation étudiée est une réaction d’oxydo-réduction en écrivant les demi-équations électroniques, puis l’équation de la réaction globale. Oxydation de l'élément calcium : Ca (s) = Ca2+aq + 2e-. Réduction de l'eau : 2H2O +2e- = H2(g) + 2HO-aq. Bilan : Ca (s) + 2H2O = Ca2+aq +H2(g) + 2HO-aq. Il y a échange d'électrons entre le calcium et l'eau : il s'agit d'une réaction d'oxydoréduction. Le squelette d’un homme adulte a une masse moyenne m = 12,0 kg. Les os sont constitués par de l’eau (50 % en masse), des composés organiques (25 % en masse) et des composés minéraux (25 % en masse). En première approximation, on peut admettre que le phosphate de calcium Ca3(PO4)2 est l’unique composé minéral présent dans les os. En négligeant toute présence de calcium hors des os, évaluer la masse mCa totale de calcium présente chez un adulte. Masse de phosphate de calcium : 0,25 m = 3,0 kg. Masse molaire du phosphate de calcium M = 3*40 + 2(31+4*16) =310 g/mol % massique de calcium dans les os : 120 / 310 *100 = 38,71 % Masse de calcium dans les os : 0,3871*3,0 = 1,1613 ~1,2 kg.
Bien
que présentant un aspect fortement minéral, les os sont des tissus
vivants. Le calcium du squelette est en renouvellement permanent, 20 %
de la masse totale de calcium se trouvant remplacée en environ une
année (on considérera 360 jours). Sachant qu’un litre de lait apporte
1110 mg de calcium, quel
volume de lait devrait boire un adulte quotidiennement s’il voulait
couvrir complètement, avec ce seul aliment, ses besoins en calcium
? Etude de la dureté d'une eau. L’eau contient un certain nombre d’ions, dont les ions calcium et magnésium. On appelle « dureté d’une eau » la grandeur sans dimension d définie en fonction des concentrations molaires en ions calcium et ma-gnésium (exprimées en mol.L-1) par la relation suivante : d = ([Ca2+] + [Mg2+]) / 1,0 10-4. L’eau est considérée comme dure si d ≥ 30. Mise en évidence de la présence d'ions calcium. Les ions calcium Ca2+ forment avec les ions oxalate C2O42- un précipité blanc d’oxalate de calcium de produit de solubilité Ks=4,0 10-9. Écrire l’équation traduisant la formation du précipité d’oxalate de calcium. À quelle condition sur les concentrations molaires initiales des différents ions y a-t-il précipitation ? Ca2+aq +C2O42- aq =Ca C2O4. Il y a précipitation si le produit [Ca2+]0[C2O42- ]0 devient supérieur ou égal à Ks. Une eau dure possède une concentration molaire en ions calcium [Ca2+]0 = 4,0.10-3 mol.L-1. Quel volume minimal Vm d’une solution d’oxalate d’ammonium à C0 = 1,0.10-3 mol.L-1 faut-il verser dans un tube à essais contenant V0 = 10 mL d’eau pour voir apparaître le précipité (on pourra négliger la dilution) ? Conclure sur la pertinence d’un test à l’oxalate d’ammonium pour mettre en évidence qualitativement la présence d’ions calcium dans une solution. [Ca2+]0[C2O42- ]0 = 4,0 10-9. [C2O42- ]0 = 4,0 10-9 / 4,0.10-3 =1,0 10-6 mol/L. Quantité de matière d'oxalate d'ammonium : Vm C0 = V0 [C2O42- ]0 ; Vm = V0 [C2O42- ]0 / C0 = 10 *1,0 10-6 / 1,0.10-3 = 1,0 10-2 mL. Vm étant très faible, le test est très sensible. L’ion oxalate C2O42- est en fait une dibase intervenant dans les couples de l’acide éthanedioïque H2C2O4 (pK1 = 1,3 et pK2 = 4,3). Écrire les deux couples acido-basiques associés à l’acide éthanedioïque et tracer le diagramme de prédominance des espèces appartenant à ces couples. H2C2O4 / HC2O4- et HC2O4- / C2O42-. 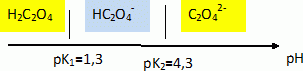 Au pH d’une eau usuelle, l’ion oxalate est-il bien l’espèce majoritaire ? Justifier votre réponse. Le pH d'une eau usuelle est de l'ordre de 7, valeur bien supérieure à pK2 : l'ion oxalate est l'espèce majoritaire à pH voisin de 7.
Dosage des ions calcium et magnésium. On utilise un dosage complexométrique par l’EDTA, dans un milieu tamponné à pH = 9 (obtenu à l’aide d’un tampon ammoniacal). On dose les deux ions simultanément selon le protocole suivant : • Pipeter exactement Veau = 50,0 mL de l’eau étudiée et l’introduire dans un erlenmeyer de 150 mL. • Ajouter une solution d’ammoniac à 7 mol.L–1 jusqu’à atteindre pH = 9. • Ajouter un peu de noir Eriochrome T (NET) de telle sorte que la solution soit colorée de manière soutenue tout en laissant encore la lumière traverser la solution. • Doser la solution obtenue par l’EDTA à C1 = 5,00.10–2 mol.L–1. Le volume équivalent est repéré par le changement de couleur de la solution. On repère pour l’expérience ainsi réalisée V1 = 10,7 mL.L’EDTA (ou éthylène diammine tétracétate) est une tétrabase, notée Y4–, associée au tétracide H4Y. À pH = 9, Y4– est la forme majoritaire. Le NET donne en présence d’ions Mg2+ une coloration rouge due à la formation d’un complexe coloré. En l’absence d’ions Mg2+, et dans le domaine de pH considéré, la couleur d’une solution contenant du NET est bleue. On supposera que l’eau étudiée contient suffisamment d’ions Mg2+ pour que le changement de couleur serve d’indication de dosage de Ca2+ et Mg2+. Faire un schéma clair et annoté du dispositif mis en oeuvre pour le dosage. 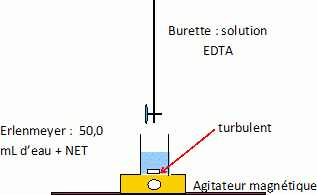 Écrire les équations de complexation des ions Ca2+ et Mg2+ par l’EDTA. Ca2+ +Y4- = CaY2– ; Mg2+ +Y4- = MgY2–. Exprimer, à l’équivalence, [Ca2+]eau+[Mg2+]eau en fonction de C1, V1 et Veau. Faire ensuite l’application numérique. Quantité de matière initiale d'ion calcium et magnésium : ([Ca2+]eau+[Mg2+]eau )Veau. Quantité de matière EDTA versé à l'équivalence : C1 V1 ; A l'équivalence : C1 V1 = ([Ca2+]eau+[Mg2+]eau )Veau. [Ca2+]eau+[Mg2+]eau = C1 V1 / Veau = 5,00.10–2 * 10,7 / 50,0 =1,07 10-2 mol/L. Calculer d relative à l’eau étudiée et conclure quant à sa dureté. d = ([Ca2+] + [Mg2+]) / 1,0 10-4 = 1,07 10-2 / 1,0 10-4 = 107, valeur supérieure à 30 : l'eau est "dure".
|
|||||||
| |
|||||||
|
|