|
|
Exercice 1.
Un gaz parfait est contenu dans un cylindre fermé par un piston mobile
sans frottement.
Les transformations représentées sur le diagramme sont quasi-statiques.
P1 = 1 bar ; T1 = 283 K ; V1 = 120 L.
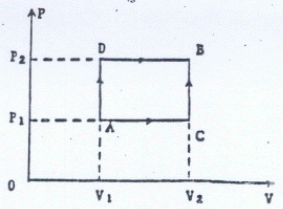
Sur le chemin ACB les chaleurs et le travail échangés valent, en valeur
absolue, respectivement 17,3 kJ et 1,41 kJ.
Préciser les signes
de WACB et de QACB.
La
transformation C--> B est une isochore ( volume constant
) : le travail élémentaire des fores de pression est dW = - PdV =0 ( car V est constant)
La transformation A-->C est une isobare : WAC = -P1(V2-V1),
négatif.
WACB
est donc négatif
: le gaz fourni du travail.
La loi des gaz pafait conduit à : en A : P1V1
= nRT1 ; en C : P1V2
= nRT2 ;
nRT1 /V1
= nRT2 /V2
; V2
> V1
conduit à T2
> T1.
en B
: P2V2
= nRT3 ; nRT2
/P1
= nRT3 /P2
; P2
> P1
conduit à T3
> T2.
La variation d'énergie interne du gaz vaut : DUAC = Cp( T2- T1),
positive ; DUCB = Cv( T3- T2),
positive ;
de plus : DUACB = WACB
+ QACB ; par suite QACB est positif.
Variation
de l'énergie interne du gaz.
DUACB = WACB
+ QACB = -1,41 + 17,3 =15,89 kJ~15,9 kJ.
|
|
Selon le chemin ADB, on doit fournir au gaz une
chaleur de 17,85 kJ.
Quel est le travail échangé avec l'extérieur ?
L'énergie interne est une
fonction d'état ; sa variation ne dépend que de l'état initial et de
l'état final :
DUACB =DUADB = WADB
+ QADB = 15,89 kJ
QADB
= +17,85 kJ
WADB
=15,89-17,85 = -1,96 kJ.
|
Calculer la pression P2 et
le volume V2 dans l'état B.
WAC
=WACB
= -P1(V2-V1)
= -1,41 kJ = -1410 J
P1 = 1
bar =105 Pa ; V1 = 120
L = 0,12 m3.
V2-V1
=1410 / 105 =
1,41 10-2 m3 ; V2=
0,12 + 1,41 10-2
= 0,1341 m3 ~134 L.
La
transformation A--> D est une isochore ( volume constant
) : le travail élémentaire des fores de pression est dW = - PdV =0 ( car V est constant)
La transformation D-->B est une isobare : WDB = -P2(V2-V1)=
-1,96 kJ = -1960 J.
P2=
1960 / 1,41 10-2
=1,39 105 Pa = 1,39 bar.
Quel
est entre A et B la variation molaire d'énergie interne ?
P1V1
= nRT1 ; n = P1V1
/( RT1
) =105*0,12
/ (8,31*283) =5,10 mol.
DUACB
=15,89 kJ ; par suite : 15,89 / 5,10 = 3,12 kJ mol-1.
On
ne sait plus quelle bouteille de gaz on a utilisé pour remplir le
cylindre. On hésite entre azote et hélium.
D'après
le résultat précédent peut-on déterminer la nature du gaz ?
On donne en J K-1 mol-1 : Cv(He)
= 1,5 R et Cv(N2) = 2,5 R.
DUAC = Cp( T2- T1)
; DUCB = Cv( T3- T2) ;
DUACB = DUAC +DUCB = Cp(
TC- T1)
+ Cv(
TB- TC)=
3,116 103 J mol-1.
TC
= P1V2/(nR) =105*0,1341 /(5,10*8,31)
=316,4 K
TB
= P2V2/(nR) =1,39 105*0,1341
/(5,10*8,31) =439,8 K
TC- T1=
316,4-283 = 33,4 K ; TB- TC
=439,8-316,4 =123,4.
Par suite : 33,4
Cp
+
123,4 Cv=
3,12 103 ;
Relation de Meyer : Cp
- Cv = R.
33,4 (R + Cv ) +
123,4 Cv=
3,116 103 ;
277,5 + 156,8 Cv=
3,12 103 ;
Cv=
18,12 ; diviser par R =8,31 SI ; Cv =2,2R.( diazote N2 )
.
|
|