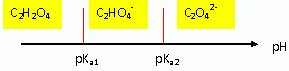Dosage de
l'acide oxalique C2H2O4
par la soude Na+ +HO-.
Dosage de la
première acidité de l'acide oxalique :
Couples acide / base
: C2H2O4
/ C2HO4- ;
H2O / HO-.
C2H2O4
+HO-=C2HO4- +H2O
Dosage de la seconde
acidité de l'acide oxalique :
Couples acide / base
: C2HO4- / C2O42- ;
H2O / HO-.
C2HO4- +HO-=C2O42- +H2O.
Prédominance des espèces
:
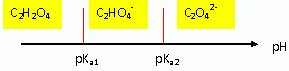
à pH = pKa1 ( 1ère demi équivalence) [C2H2O4]=[C2HO4-]
à pH = pKa2
( 2ème demi équivalence) [C2HO4-]=[C2O42-]
|
Indicateurs colorés utilisables.
La
zone de virage de l'indicateur coloré doit contenir le pH du point
équivalent.
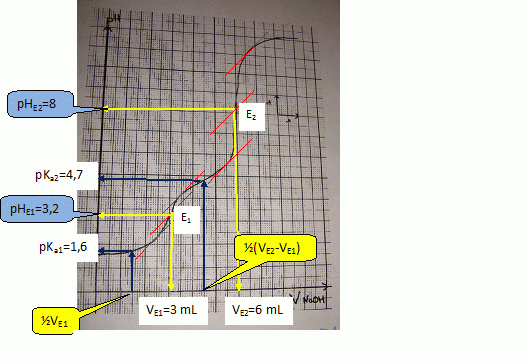
E1 : hélianthine [ 3,2 ; 4,4 ] rouge à jaune.
E2 : rouge de crésol [7,2 ; 8,8 ) jaune à rouge.
|
Le
second saut de pH est beaucoup plus marqué ; la détermination de E2
est plus précise. On l'utilisera pour déterminer la concentration de
l'un des réactifs.
C2H2O4
+2HO-=C2O42- +2H2O. (1)
Calcul de la concentration de la
soude NaOH à 1% près si la masse d'acide oxalique C2H2O4
, 2H2O
dans le becher est m = 132,2 mg.
Masse molaire de
l'acide oxalique dihydraté : M = 2*12+2+4*16+2*18 = 126 g mol-1.
noxa
= m/M = 0,1322 / 126 = 1,05 10-3 mol.
Quantité de
matière de soude versée à la seconde équivalence : nNaOH =
CNaOH VE2 = CNaOH *6 10-3
mol.
Les
nombres stoechiométtriques de (1) donnent : nNaOH
= 2 noxa ;
CNaOH
*6 10-3 = 2*1,05 10-3 ; CNaOH
= 2,1 / 6 = 0,35
mol L-1.
Exercice
2.
Quel
volume de gaz ammoniac faut-il dissoudre dans V =300 mL d'eau distillée
dans les
conditions standards pour obtenir une solution de concentration C
=0,10 mol/L ?
Quantité de matière d'ammoniac : n = C V = 0,10*0,30 = 0,030 mol
Volume de gaz ammoniac : n Vm = 0,030*22,4 =0,67 L.
La
solution obtenue a un pH de 11,1.
Calculer
la concentration des ions H3O+ et
OH- qu'elle contient.
Est ce une solution acide, basique, neutre ?
A 25°C, une solution dont le pH est supérieur à 7 est basique.
[H3O+] = 10-pH
= 10-11,1 =7,94 10-12 ~ 7,9 10-12 mol/L.
Le produit ionique de l'eau conduit à : [OH-]
=10-14 / [H3O+] = 10-14
/ 7,94 10-12
~1,3 10-3 mol/L.
Exercice 3.
Quel
volume de gaz bromure hydrogène faut-il dissoudre dans V =5,0 litres
d'eau pure pour
obtenir une solution de concentration c=2,0 10-2 mol/L dans les
conditions
standards.
Quantité de matière
de chlorure d'hydrogène : n = C V = 0,02*5 = 0,10 mol
Volume de gaz : n Vm = 0,1*22,4 =2,2 L.
La solution
aqueuse a un pH=1.7.
Faire
l'inventaire des espèces
chimiques présentes dans la solution. Calculer leur concentration.
La solution contient des ions chlorure Cl- et oxonium H3O+.
La réaction du chlorure d'hydrogène avec l'eau est totale :
HCl(g) + H2O(l) = Cl- aq + H3O+aq.
[H3O+aq] =[Cl- aq] = c =2,0 10-2 mol/L.
Execice 4.
On
dissout 0,20 g d'hydroxyde de sodium dans l'eau pure pour obtenir V =
0,10 litre de
solution.
Ecrire l'équation
bilan de la dissolution. Calculer le pH.
NaOH (s) = Na+aq + HO-aq.
Masse molaire de la soude NaOH : M = 23+1+17 = 40 g/mol.
Quantité de matière de soude : n = m/ M = 0,20 / 40 = 5,0 10-3
mol.
C = [HO-aq] = n/V = 5,0 10-3
/0,10 = 5,0 10-2
mol /L.
Le produit ionique de l'eau conduit à : [H3O+] =10-14
/ [OH-]
= 10-14
/ 5,0 10-2 =2,0 10-13 mol/L.
pH = -log [H3O+] =-log 2,0 10-13 =12,7.
Quel volume d'eau
faut il ajouter à 20 mL de la solution précédente pour
obtenir un pH=11 ?
On conduit les
calculs avec l'espèce majoritaire en milieu basique, l'ion
hydroxyde.
[HO-aq]début =5,0 10-2 mol/L ; n HO- début = 0,05*0,02 = 10-3
mol.
[HO-aq]fin=10-14
/ 10-11 = 10-3 mol/L ; n HO-
fin = 0,001*(0,02 + Veau)= 10-3 mol.
0,02 + Veau= 1 ; Veau = 0,98 L.
|
Exercice 5.
On
prépare 3 solutions aqueuses S1, S2, S3
du même acide
AH. La solution S1 est de concentration c, S2 a
une concentration c2 =0,1c et S3
a une concentration c3 =0,001c
Le
pH est mesuré à 25°C. On trouve respectivement : 4,25, 4,75 et
5,25.
Montrer
que l'acide est faible.
On dilue 10 fois S1 pour obtenir S2 et le pH
varie de 0,5 unité : l'acide est donc faible.
Le pH d'un acide fort varie de 1 unité lors d'une dilution au 10è.
Ecrire
l'équation bilan de la réaction de l'acide avec l'eau.
AH aq + H2O(l) = A-aq + H3O+aq.
Quelles
sont les espèces chimiques présentes dans les solutions ?
AH
aq,
H3O+aq, HO-aq ( minoritaire)
Calculer la
concentration de chaque espèce chimique présente dans S2 sachant
que sa concentration est de 10-3 mol/L.
[H3O+aq]=
10-pH = 10-4,75 =1,77 10-5 ~1,8 10-5 mol/L.
Le produit ionique de l'eau conduit à : [OH-]=10-14
/ [H3O+]
= 10-14
/ 1,77
10-5 =5,6 10-10 mol/L.
La solurion est électriquement neutre : [OH-]
+[A-]
=[H3O+]
;
[A-]
=1,8 10-5 -5,6 10-10 ~1,8 10-5 mol/L.
Conservation de A : [A-]
+ [AH] =10-3.
[AH] =10-3-1,8
10-5 =9,8
10-4 mol/L.
Exercice 6.
On mélange 20
mL d'une solution de chlorure d'hydrogène de pH=2,0 et 50 mL d'une
solution de chlorure d'hydrogène de pH=4,0.
Déterminer
la quantité de matière
d'ions H3O+ dans le mélange et
en déduire le pH du mélange.
HCl(g) + H2O(l)
= Cl- aq + H3O+aq ( totale).
Quantité de matière
de chlorure d'hydrogène, donc d'ion oxonium :
n= 0,020 *10-2 + 0,05 *10-4 = 2,05 10-4
mol.
Volume du mélange : V =20 +50 = 70 mL = 0,070 L.
[H3O+aq]
= n / V = 2,05 10-4
/0,07 =2,93 10-3 mol/L
pH = - log [H3O+aq]
= - log 2,93 10-3
=2,5. |