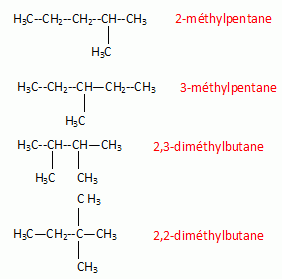
Ecrire la
formule semi-développée et nommer tous les alcanes isomères de formule
brute C6H14.
CH3-CH2-CH2-CH2-CH2-CH3
hexane.
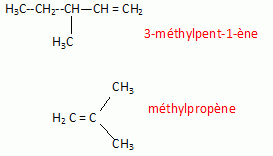
Par craquage catalytique d'un cyclane substitué on obtient un
mélange des produits suivants : dihydrogène, méthane, benzène,
méthylpropène et 3-méthylpent-1-ène.
Ecrire la
formule semi-développée des produits obtenus ( formule brute
pour le benzène).
H2 : dihydrogène ; CH4 :
méthane ; C6H6 : benzène.
Un composé A non
cyclique, de formule brute C6H12 a une chaîne
carbonnée linéaire.
Quelle
est sa famille chimique ?
La formule brute d'un alcène est Cn H2n.
Donner le
nom et la formule semi-développée des différents isomères.
CH3-CH2-CH2-CH2-CH=CH2
hex-1-ène.
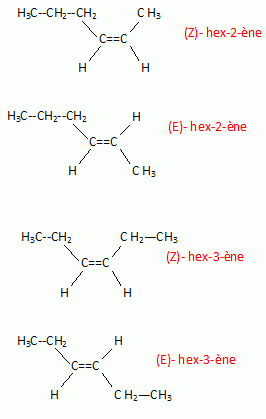
Identifier
A sachant que sa molécule possède un élément de symétrie. Peut-on
l'identifier complètement ?
Les deux molécules suivantes possèdent un élément de symétrie :
(Z)-hex-3-ène
: plan de symétrie et (E)-hex-3-ène : centre de symétrie.
Parmi les
composés obtenus par craquage du cyclane, lequel est isomère à chaîne
ramifiée de A ?
3-méthylpent-1-ène.( même formule brute que A)
Un polymère obtenu par polyaddition a une masse molaire MP =87500 g/mol. Son degré moyen de polymérisaion est n = 1400.
Calculer la masse molaire M1 du monomère en admettant qu'elle est égale à celle du motif du monomère.
M1 = MP/n = 87500 / 1400 =62,5 g/mol.
On donne la composition du monomère : chlore : 56,8 % ; carbone : 38,4 % et le reste en hydrogène.
C : 12 ; Cl : 35,5 ; H : 1 g/mol.
Calculer les masses de chlore, de carbone et d'hydrogène dans une mole de monomère.
mCl =62,5*0,568 =35,5 g ; mC = 62,5 *0,384 =24 g ;
% hydrogène : 100-56,8-38,4 =4,8 % ; mH = 62,5 *0,048 =3 g.
Donner la formule semi-développée et le nom du monomère.
C2H3Cl ; H2C=CHCl chlorure de vinyle ou chloroéthène
Donner la configuration électronique des atomes d'hydrogène, de carbone et de chlore.
H : 1 électron K1 ; C : 6 électrons K2L4 ; Cl ( Z= 17) : 17 électyrons K2L8 M7.
Calculer le nombre total nd de doublets liants et non liants.
H : 1 doublet liant ; C : 4 doublets liants ; Cl : 1 doublet liant et 3 doublets non liants.
4 liaisons de covalence à partir de chaque carbone soit 6 doublets de liaisons
Ajouter à cela 3 doublets non liants autour du chlore.
En déduire la structure de Lewis de la molécule.
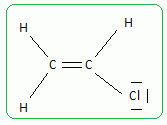
La molécule est plane et les angles sont voisins de 120 °.
Autour de chaque atome de carbone il y a trois directions de liaisons,
3 doublets liants se repoussant le plus loin possible les uns des
autres.
Ecrire la réaction de polymérisation du composé H2C=CHCl.
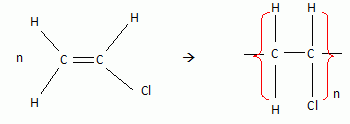
Indiquer le nom usuel du monomère et du polymère.
monomère : chlorure de vinyle ; polymère : polychlorure de vinyle ( PVC).
Citer deux objets courants fabriqués à partir du polymère
Tuyaux de canalisation, revêtement de sol, film adhésif.