Une
expérience simple à réaliser pour épater la famille, consiste à
alimenter un réveil avec un citron !! Et oui à l'aide d'une pièce de
cuivre, d'un clou en zinc, de quelques fils électriques et d'un citron,
on peut réussir à faire fonctionner un réveil ou une calculatrice. Cet
exercice permet d'expliquer scientifiquement le phénomène.
On donne : M(Zn) = 65,4 g/mol ; 1 F = 9,6 104 C / mol ; couples oxydant / réducteur : Zn2+aq / Zn(s) ; H+aq / H2(g).
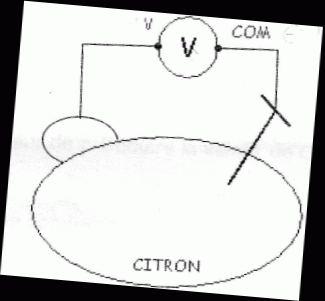
On
souhaite connaître la force électromotrice U de cette pile au citron.
Pour cela on branche un volmètre entre le clou et la pièce. On mesure U
= 0,69 V
Déterminer la polarité de la pile au citron. Justifier.
U
est positive, donc le cuivre est la borne positive reliée à "V" du
volmètre ; le zinc est la borne négative de la pile, reliée à la
borne "COM" du voltmètre.
Au cours de son utilisation on constate une effervescence au niveau de
la pièce. Après analyse du gaz, on en déduit qu'il s'agit de
dihydrogène.
Décrire simplement une expérience permettant de mettre en évidence la nature du gaz émis.
Le
mélange dihydrogène - air ( dioxygène ) est explosif en toutes
proportions. Approcher une flamme ( allumette) du gaz qui se dégage :
on entend une petite explosion.
Donner les demi-équations des réactions ayant lieu à chaque électrode. Préciser le type de réaction ( oxydation ou réduction ). Quels noms donnent-on aux électrodes ?
Oxydation du zinc à l'anode négative : Zn(s) = Zn2+aq + 2e-.
Réduction de H+aq à la cathode positive : 2 H+aq + 2e- = H2(g).
Ecrire la réaction globale de la réaction se produisant au cours du fonctionnement de la pile.
Zn(s) +2 H+aq = Zn2+aq + H2(g).
D'où proviennent les ions H+aq ?
Le jus de citron contient plusieurs acides. Ces derniers sont plus ou moins ionisés , d'où la présence des ions H+aq.
La
pile est utilisée pour faire fonctionner une petite calculatrice
pendant 1 min 36 s. L'intensité du courant débité est égale à 10 mA..
Quelle quantité d'électricité est débitée par la pile ?
Q = I t avec I = 0,010 A et t = 60 +36 = 96 s.
Q = 0,010 *96 = 0,96 C.
Dresser le tableau d'avncement pour la réaction qui a lieu au niveau du clou.
|
avancement (mol)
|
Zn(s)
|
=Zn2+aq |
+ 2e- |
initial
|
0
|
n
|
0
|
0
|
en cours
|
x
|
n-x
|
x
|
2x
|
final
|
xmax
|
n-xmax |
xmax |
2xmax |
|
Calculer la quantité de matière de zinc consommée. En déduire la variation de masse Dm du clou.
Quantité de matière d'électron : n(e-)= Q / 9,6 104 = 0,96 / 9,6 104 =1,0 10-5 mol.
Quantité de matière de zinc consommé : n(Zn) =½ n(e-)= 5,0 10-6 mol.
Masse de zinc consommée : Dm = -n(Zn) m(Zn) = -5,0 10-6 *65,4 = 3,3 10-4 g.
Le clou a été pesé avant la fabrication de la pile : m i = 26,2 g
Peut-on vérifier expérimentalement la valeur de Dm ?
La précision de la balance utilisée est le décigramme. On ne peut donc pas vérifier, avec cet instrument, la valeur de Dm. Pour cela, il faudrait une balance beaucoup plus précise.
|
|