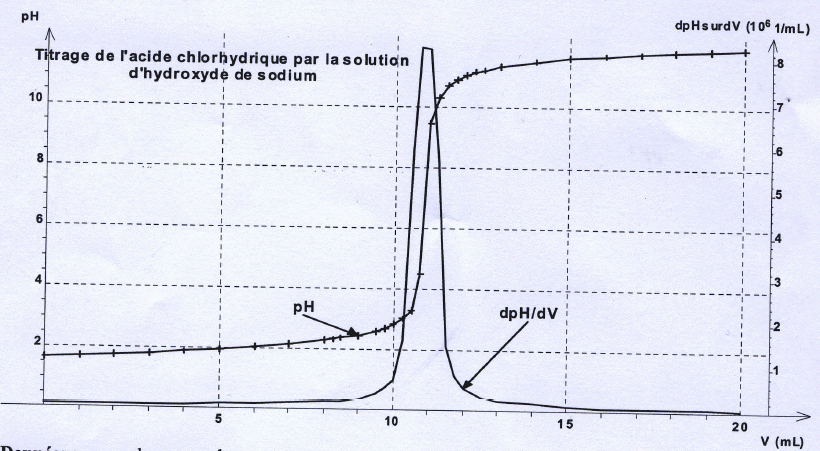
Titrage.
On donne : couples acide / base : H3O+aq/
H2O (l) pKa1 = 0 ; H2O (l) /HO-aq pKa2 =pKe = 14.
On réalise un titrage d'un volume VA d'acide chlorhydrique
de concentration apportée CA inconnue placée dans un becher
d'environ 250 mL par une solution titrante d'hydroxyde de sodium de
concentration apportée CB placée dans une burette graduée de
25 mL. On notera VE le volume versé à l'équivalence. On
donne VA = 20,0 mL, CB = 0,100 mol/L.
Quel est
le but d'un titrage ?
Un titrage permet de déterminer la concentration inconnue d'une espèce
chimique en solution.
Définir
l'état d'équivalence d'un système physico-chimique.
A l'équivalence, les quantités de matière des réactifs mis en présence
sont en propotions stoechiomètriques.
Dans ce cas, avant l'équivalence, l'acide chlorhydrique est en excès
dans le becher ; après l'équivalence, l'autre réactif, la soude est en
excès.
Pour un
avancement x inférieur à l'avancement à l'équivalence xE, quel est le
réactif limitant ?
Avant l'équivalence, l'hydroxyde de sodium est en défaut dans le becher
: l'ion hydroxyde est le réactif limitant.
|
Pour un volume V, inférieur à VE, de
solution d'hydroxyde de sodium versé, établir l'expression
littérale du taux d'avancement t en fonction du pH,
Ke, VA, V et CB.
H3O+aq + HO-aq =2H2O (l) K=1/([H3O+aq][HO-aq]) =1/ Ke.
[HO-aq] = Ke/ [H3O+aq] = Ke / 10-pH.
n(HO-aq) = [HO-aq] (VA+V) = Ke(VA+V)/ 10-pH.
Le tableau suivant est établi à partir du mélange hypothétique CAVA mol d'acide et CBVE mol de base.
|
avancement
(mol)
|
H3O+aq |
+ HO-aq |
=2H2O (l) |
initial
|
0
|
CAVA
|
CBVE
|
solvant
|
en
cours
|
x
|
CAVA-x |
CBVE-xf
|
équivalence
|
xf |
CAVA-xéq |
CBVE-xéq |
V
= 1,25 VE
|
|
~0
( en défaut)
|
0,25
VECB |
|
Taux
d'avancement : xf / xmax avec xmax= CBV.
n(HO-aq) =CBV-xf = Ke(VA+V)/ 10-pH ; xf = VCB-Ke(VA+V)/ 10-pH ;
xf / xmax = 1-Ke(VA+V)/ (10-pH CBV)
Le graphe indique VE =10,8 mL ;
xf / xmax= 1-10-14(0,02+V)/ (10-pH *0,1 V).
Calculer la valeur
du taux d'avancement pour V = 0,25 VE ; V =
0,5 VE ; V = 0,75 VE.
Lecture graphe pH0,25 ~1,9 ; t0,25
= 1-10-14(0,02+0,0027)/ (10-1,9 *0,1*0,0027) = 1.
Lecture graphe pH0,5 ~2 ; t0,5
= 1-10-14(0,02+0,0054)/ (10-2 *0,1*0,0054)= 1.
Lecture graphe pH0,75 ~2,1 ; t0,75
= [1-10-14(0,02+0,0081)/ (10-2,1 *0,1*0,0081)=1.
Que
peut-on en déduire sur la transformation chimique ? Pourquoi ?
Dans l'hypothèse d'une transformation totale : t = xf / xmax =1
t0,25 =1 ; t0,5 =1 ; t0,75 =1.
Dans les calculs précédents nous avons trouvé ces valeurs. La
transformation est donc totale.
Déterminer
les concentrations effectives des espèces chimiques pour V= VE. Justifier.
A l'équivalence nous avons une solution de chlorure de sodium de pH=7 ;
[H3O+aq]=[HO-aq]= 1,0 10-7mol/L.
La solution est électriquement neutre : [Na+aq] = [Cl-aq]
=VECB
/ ( VA+VE
) =10,8 *0,1 / 20,8 =5,2 10-2 mol/L.
Déterminer les
concentrations effectives des espèces chimiques pour V= 1,25VE.
[HO-aq] = 0,25 VECB / ( VA+VE
) =0,25*11*0,1 / 33,5 =8,1 10-3 mol/L.
[H3O+aq] = Ke / [HO-aq] = 10-14 / 8,1 10-3 =1,2
10-12 mol/L.
[Cl-aq] =VECB
/ ( VA+V
) =11 *0,1 / 33,5 =3,2 10-2 mol/L.
[Na+aq] =VCB
/ ( VA+V
) = 13,75 *0,1 / 33,5 = 4,0 10-2 mol/L.
Arôme de banane.
L'arôme synthétique de banane, appelé encore acétate de butyle, est obtenu à partir de l'acide éthanoïque et du butan-1-ol.
Expérimentalement la synthèse au laboratoire nécessite un volume VA = 5,80 mL d'acide carboxylique A et un volume VB = 18,4 mL d'alcool B et quelques gouttes d'acide sulfurique.
|
masse molaire M(g/mol)
|
masse volumique µ (g/mL)
|
température d'ébullition
sous pression normale
°C
|
solubilité
dans l'eau salée
|
pictogrammes
|
A
|
60
|
1,05
|
118,2
|
importante
|
|
B
|
74
|
0,81
|
117,7
|
très faible
|

|
ester
|
116
|
0,87
|
126,5
|
très faible |
|
acide sulfurique
|
98
|
1,80
|
340,0
|
importante |

|
eau
|
18
|
1,00
|
100,0
|
importante |
|
Etablir l'équation de la réaction qui permet d'obtenir cet arôme. Nommer l'ester formé.
CH3-COOH + CH3-CH2-CH2-CH2OH = CH3-COO-CH2-CH2-CH2 -CH3 + H2O.
Nom de l'ester : éthanoate ( acétate) de butyle.
Citer trois méthodes pour améliorer le rendement final de cette transformation sans modifier la quantité de réactif limitant.
Quantités de matière initiales :
nA = 5,80 *1,05 / 60 = 0,1015 mol ; nB =18,4 *0,81 / 74 =0,20 mol. ( en excès )
- remplacer l'acide par l'anhydride d'acide
- éliminer l'eau ( produit le plus voatil ) par distillation au fur et à mesure qu'elle se forme.
- ajouter un réactif ( l'acool) en grand excès.
Le rendement théorique est 0,66.
Il faudrait préciser " à partir d'un mélange équimolaire".
Déterminer la valeur de la constante d'équilibre.
K = [CH3-COO-CH2-CH2-CH2 -CH3][H2O] / ([CH3-CH2-CH2-CH2OH][CH3-COOH])
A partir d'un mélange équimolaire, le rendement théorique est 0,66 ~2/3.
K = (2/3)2 / (1/3*1/3) =4,0.
avancement (mol)
|
CH3-COOH |
+ CH3-CH2-CH2-CH2OH |
= CH3-COO-CH2-CH2-CH2 -CH3 |
+ H2O |
initial
|
0
|
0,1015
|
0,20
|
0
|
0
|
en cours
|
x
|
0,1015-x
|
0,20-x
|
x
|
x
|
fin
|
xf
|
0,1015-xf
|
0,20 -xf
|
xf
|
xf
|
Quelle masse d'ester peut-on obtenir dans l'état final ?
K = 4 = xf2 / (0,10-xf)(0,20-xf) ; 4xf2 -1,2xf +0,08 = xf2 ; 3xf2 -1,2xf +0,08 =0
La résolution donne : xf =0,084 mol
Masse d'ester = 0,084 *116 = 9,7 g.
Que signifie les deux pictogrammes ? Quelles consignes faut-il préconiser lors de leur utilisation ?
L'alcool est nocif et l'acide sulfurique est corrosif : port de blouse, gants, lunette et travail sous hotte.
|