acide
base.
Une solution S1 d'acide HA1 de concentration C1
et une solution S2 d'acide HA2 de concentration C2
supérieure à C1 ont le même pH. Le taux d'avancement final
de la réaction de l'acide HA1 sur l'eau est t1. Le taux d'avancement
final de la réaction de l'acide HA2 sur l'eau est t2. La constante
d'équilibre de la réaction de l'acide HA1 sur l'eau est K1. La constante
d'équilibre de la réaction de l'acide HA2 sur l'eau est K2.
A- t1 = t2. Faux.
[H3O+] = t1C1 = t2 C2. Les concentrations étant
différentes, le pH étant le même, les taux d'avancement finaux sont
différents.
B- t1 > t2. Vrai.
t1C1 = t2 C2 et C2
supérieure à C1 donc t1
> t2.
C- K1
>K2. Vrai.
K = [H3O+][A-] /
[AH] = [H3O+]2 / [AH]
d'où : K1[HA1] = K2[HA2] ; K1C1(1-t1) = K2C2(1-t2) ;
or (1-t1) <(1-t2) et C1 < C2 : donc K1 >K2.
Tampon.
A 30 mL d'une solution tampon de pH=4,2 d'acide benzoïque de
concentration dans le mélange 0,10 mol/L et de benzoate de sodium, on
ajoute 1,5 mL d'acide chlorhydrique de concentration c = 0,10 mol/L,
sans variation de volume ; pKa(C6H5COOH /C6H5COO- ) = 4,2
A-
L'équilibre de dissociation de l'acide benzoïque se déplace dans le
sens direct. Faux.
Equilibre dissociation acide benzoïque : C6H5COOH
+ H2O =C6H5COO- + H3O+.
Réaction acide base suite à l'ajout d'acide chlorhydrique : C6H5COO- + H3O+=C6H5COOH + H2O.
B- Le pH
final vaut 3,7. Faux.
|
avancement
(mmol)
|
C6H5COO- |
+ H3O+ |
C6H5COOH |
+ H2O |
initial
|
0
|
30*0,1
= 3
|
30 10-4,2
+0,15 =0,152
|
30*0,1
= 3 |
solvant
|
en
cours
|
x
|
3-x
|
0,152-x
|
3+x
|
grand
|
fin
|
xmax
=0,152
|
3-xmax
=2,85
|
~0
|
3,15
|
excès
|
pHfin = pKa + log [C6H5COO-] / [C6H5COOH] = 4,2 + log (2,85 / 3,15) =4,15.
C- La quantité de matière
d'acide benzoïque à l'état final est 0,15 mol. Faux.
D. Si on dilue 10 fois la
solution résultante le pH est 4,7. Faux.
Les concentrations d'acide benzoïque et d'ion benzoate varient dans les
mêmes proportions.
|
acide lactique.
Le lait frais contient peu d'acide lactique CH3-CH(OH)
COOH. ( pKa = 3,9)
Pour savoir si le lait est frais, on le dose par la soude de
concentration 2,0 10-2 mol/L. On introduit dans un
erlenmeyer 20,0 mL de lait et quelques gouttes d'indicateur
coloré. VE = 16,2 mL et pHE = 8,2.
L'acidité d'un lait frais est inférieure à 17 °D ( 1 °D représente 0,10
g d'acide lactique par litre de lait ).
A. Le groupe carboxyle est présent
dans la molécule d'acide lactique. Vrai.
B. L'espèce
prédominante dans le lait de pH=6,7 est CH3-CH(OH)
COOH. Faux.
A pH supérieur à pKa, la base conjuguée prédomine.
C. A l'équivalence,
la solution présente est du lactate de sodium. Faux.
La solution est du lait contenant un peu de lactate de sodium.
D. la concentration
en acide lactique est 0,16 mol/L. Faux.
A l'équivalence CAVA = CB
VE ; CA = CB VE
/ VA = 0,020 *16,2 / 20 =1,6 10-2
mol/L.
E- Le lait n'est
pas frais. Faux.
M(acide lactique) = 90 g/mol ; masse d'acide
lactique dans 1 L de lait : 0,016 *90 =1,46 g soit ~15°D.
|
Sulfate d'argent.
Soit une solution telle que [Ag+]= 4,0 10-2 mol/L.
La constante d'équilibre Ag2SO4(s) = 2Ag+aq
+ SO42-aq vaut Ks = 1,6 10-5.
Si on double la concentration en ion argent, alors la concentration (
mol/L) en ions sulfate est : 2,0 10-2 ; 4,0 10-2
; 5,0 10-3 ; 2,5 10-3.
Ks = [Ag+]2[SO42-] ; [SO42-]
= Ks / [Ag+]2 ; si [Ag+] double, alors
[SO42-] est divisée par 4.
De plus, [SO42-]i = Ks /[Ag+]i2
; [SO42-]i = 1,6 10-5
/ 1,6 10-3 =1,0 10-2 mol/L.
[SO42-]f = 1,0 10-2
/4 = 2,5 10-3 mol/L.
Electrolyses.
A- Une réaction d'électrolyse a lieu
grâce à l'apport d'énergie chimique fournie par le générateur. Faux.
Le générateur fournit de l'énergie électrique.
B-
A l'anode, s'effectue une oxydation et à la cathode une réduction. Vrai.
C- les cations se
déplacent vers la cathode, les anions vers l'anode. Vrai.
En solution, les cations se
déplacent dans le sens du courant, de l'anode positive vers la cathode
négative.
D- Comme tout récepteur
électrique, un électrolyseur est caractérisé par une force
électromotrice et par une résistance interne. Faux.
Vrai si on compte la force
électromotrice avec un signe moins ; un conducteur
ohmique est un récepteur sans force électromotrice.
E- L'électrode d'entrée
est appelée cathode.
Faux.
L'anode est positive: le
courant entre par l'anode.
On place en série deux électrolyseur munis d'électrodes en
carbone graphite. Le premier contient 100 mL de nitrate d'argent à
0,100 mol/L et le second 100 mL de sulfate de cuivre à 0,100 mol/L.
En 10 min la masse de la cathode du premier électrolyseur a augmenté de
0,648 g. M(Ag) = 108 g/mol ; M(Cu) = 63,5 g/mol ; F = 96500 C /mol.
A- L'intensité du courant
est I = 0,965 A. Vrai.
Ag+aq + e- = Ag(s) ; n(e- ) =
n(Ag(s)) = 0,648 / 108 =0,006 mol
Quantité d'électricité Q = 0,006*96500 C
Q = I t avec t = 600 s ; I = 0,006*96500 / 600 = 0,965 A.
B- L'augmentation de
masse de la seconde cathode est 0,381 g. Faux.
Cu2+aq + 2e- =
Cu(s) ; n(Cu(s)) = 0,5n(e-) = 0,003 mol
masse de cuivre déposé : 0,003*63,5 =0,19 g.
C- la
concentration finale des ions argent est : 0,04 mol/L.Vrai.
La quantité de matière des ions argent diminue
de 0,006 mol en 10 min.
La quantité de amtière initiale était 0,01 mol ; il reste donc 0,004
mol d'ion argent dans 0,1 L soit 0,04 mol/L.
D- la concentration
finale des ions cuivre est : 0,04 mol/L. Faux.
La quantité de matière des ions
cuivre diminue de 0,003 mol en 10 min.
La quantité de amtière initiale était 0,01 mol ; il reste donc 0,006
mol d'ion cuivre dans 0,1 L soit 0,06 mol/L.
Conductimétrie.
Le taux d'avancement final de la réaction de l'acide éthanoïque sur
l'eau dans une solution S1 de concentration C1 =
1,0 10-3 mol/L( 1 mol m-3) est t1 = 0,12. On prélève
10 mL de cette solution, on les verse dans une fiole jaugée de 100 mL
et on complète avec de l'eau distillée jusqu'au trait de jauge. On
obtient S2. On mesure avec la même cellule la conductance de
la solution S1, G1 = 48 µS et la conductance de S2,
G2 = 12 µS.
A- Le rapport des
concentration C2/C1 = 4. Faux.
On dilue 10 fois S1, le rapport C2/C1
vaut : 0,1.
B- Le rapport des
conductivité s2/s1 = 0,25. Vrai.
Conductance
et conductivité sont proportionnelles : s2/s1 =G2
/G1
=0,25.
C- Le taux d'avancement
final de la réaction de l'acide éthanoïque sur l'eau dans la
solution S2 et 0,30. Vrai.
G2
= cste [H3O+]2 ; G1
= cste [H3O+]1 ; t1 =[H3O+]1
/ C1 ; cste = G1
/ [H3O+]1
= G1
/( t1 C1
) = 48 10-6 /(0,12*1) = 4 10-4 SI.
t2 =[H3O+]2
/ C2 = G2
/( cste C2 ) = 12 10-6
/(4 10-4*0,1) =0,30.
On effectue
le dosage conductimétrique d'un acide par la soude.
A- On peut ajouter de
l'eau déminéralisée au cours du dosage. Faux.
Les concentrations de toutes les espèces présentes en solution vont
diminuer. Le but est de repèrer l'équivalence avec précision, c'est à
dire l'intersection des deux segments de droites.
Ce point ne va pas changer si l'ajout se fait au début ; si l'ajout se
fait un peu avant l'équivalence, celle-ci sera plus difficile à
déterminer. Il est plus judicieux d'ajouter de l'eau distillée avant le
dosage.
B- La conductance du
mélange réactionnel diminue toujours avant le point équivalent. Faux.
A volume constant, dans le cas d'un acide fort, on remplace l'ion
oxonium par un ion de conductivité molaire ionique bien inférieure : la
conductivité diminue.
A volume constant, dans le cas d'un acide faible, on ajoute des ions
sodium à la solution et il apparaît des ions carboxylate : la
conductivité augmente lentement.
C- La
conductance augmente toujours après l'équivalence. Vrai.
On ajoute des ions sodium et hydroxyde à la solution.
D- le point équivalent
est à l'intersection de deux segments de droite de coefficients
directeurs différents. Vrai.
Dans la mesure où le volume de la solution peut être considéré comme
constant.
A propos de
cinétique.
Soit l'équation de dimérisation : 2NO2(g) = N2O4(g)
La variation de 1/[NO2] ( L mol-1)
est donnée ci-dessous :
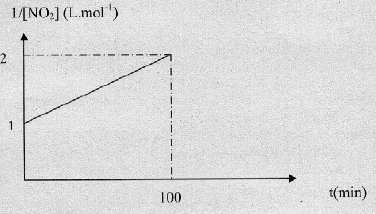
A- Le
temps de demi réaction est t½ = 50 min.
Faux.
Durée au bout de laquelle l'avancement est égal à la moitié de
l'avancement final.
n(NO2) i = 1 mol ; si la réaction est totale,
l'avancement final est 1-2xf = 0 ; xf = 0,5
mol.
xt½ =½ xf
= 0,25 mol ; n(NO2)
t½ =1-2*0,25 = 0,5 mol ; 1/ n(NO2)
t½ =2 mol-1 soit t½ = 100 min.
B-
Le temps de demi réaction est t½ = 100 min.
Vrai.
C- La vitesse de la
réaction est définie par : v = -½d[NO2]/dt.
Vrai.
On note x, l'avancement en mol.
v = 1/V dx/dt avec n(NO2)
=1-2x ; d n(NO2)/ dt =
-2dx/dt ; dx/dt = -½d n(NO2)/ dt.
v = -½/V d n(NO2)/ dt = -½d[NO2]/dt.
D- La vitesse de la
réaction est définie par : v = -d[NO2]/dt. Faux.
On dit qu'un catalyseur est sélectif :
A- s'il augmente la
vitesse de formation d'un produit au détriment d'un autre. Vrai.
B- s'il agit de façon non
prévisible sur les réactifs. Faux.
C- s'il nécessite des
conditions de température ou de pression particulières pour agir. Faux.
D- s'il augmente la
vitesse d'évolution d'une transformation de façon privilégiée. Vrai.
|
La réaction entre l'eau
oxygénée et les ions iodure produit du diiode. On mesure l'absorbance
A(t) de la solution au cours du temps. La seule espèce absorbante est
le diiode. Les mesures sont effectuées dans une cuve de 1 cm avec un
coefficient d'absorption molaire pour le diiode e = 4360 L mol-1 cm-1.
L'absorbance de la solution est donnée par :
A(t) = 1,125 (1-exp(-0,03 t).
A- L'absorbance au
bout d'un temps infini est égale à zéro. Faux.
A(infini)=1,125(1-0) = 1,125.
B-
L'absorbance à t = 0 est égale à 1,125. Faux.
A(0) = 1,125(1-exp0) = 1,125(1-1) = 0 (
il n'y a pas encore de diiode).
C- La concentration
de diiode au bout d'un temps infini est éagle à 2,5 10-4
mol/L. Vrai.
A = e L[I2] ; [I2]oo = Aoo
/ (e L) =1,125 / 4360 ~ 2,5 10-4 mol/L.
D- Le temps de
demi-réaction est 22 min. Faux.
On donne ln(0,58 / 1,125) =-0,66.
A t½, l'absorbance est égale à la moitié de sa valeur finale
soit 1,125 / 2.
1,125 / 2 = 1,125 (1-exp(-0,03 t½).
0,5 = 1-exp(-0,03 t½) ; exp(-0,03 t½) = 0,5 ; -ln 2 = -0,03 t½ ; t½ =0,69 / 0,03 ~23 unités
de temps ( non précisée dans le texte).
Echange
thermique.
A- La fusion
nécessite un apport d'énergie. Vrai.
B- La chaleur
latente d'exprime en J mol-1. Faux.
En J kg-1.
C- Lorsque la glace
fond, sa température augmente. Faux.
Tant qu'il y a de l'eau liquide et de la glace, la température du
mélange reste constante. ( °C sous 1 bar).
D- Lorsque le
solide se solidifie, son volume diminue toujours. Faux.
Le volume de la glace est supérieur à celui du liquide correspondant.
Chimie
organique.
A- On obtient une
imine avec une cétone et une amine primaire. Vrai.
B- On obtient une
imine par une réaction de condensation. Vrai.
C- La réaction qui
conduit à une imine n'est pas totale, car une imine est hydrolysable. Vrai.
D- En présence de 2,4-DNPH, les composés carbonylés donne un
précipité de 2,4-dinitrophénolhydrazone. Faux.
2,4-dinitrophénylhydrazone.
Soient les trois équations de réaction :
(1) : 2 CH3-COOH = A + H2O
(2) : A + propan-1-ol = B + CH3-COOH
(3) : B + HO- = C+D.
A- B est
l'anhydride éthanoïque. Vrai.
B- B est le
propanoate d'éthyle.
Faux.
B est l'éthanoate de propyle.
C- C est l'ion
propanoate. Faux.
C est l'ion éthanoate.
D- D est l'éthanol.
Faux.
D est le propan-1-ol.
|
|