Nombre quantique.
-
deux électrons d'un même atome peuvent avoir 3 nombres quantiques
identiques
Vrai.
"les quatre nombres quantiques
de deux électrons ne peuvent pas être identiques".
- il est nécessaire de connaître les 4 nombres quantiques associés à un
électron pour connaître l'orbitale atomique dans laquelle il se trouve.
Faux.
- aux
orbitales définies par n=4 et l=3 corespondent 5 orbitales f Faux.
il y a 7 orbitales f.
- le nombre quantique
m relatif à un électron d'une orbitale 4f peut prendre la valeur
-4.
Vrai.
Orbitales.
- la forme d'une orbitale atomique dépend de l
Vrai.
Le nombre quantique orbital l
définit la forme et la symétrie de l'orbitale.
- les orbitales sont
des représentations graphiques de solutions mathématiques de l'équation
de Scrödinger ; faux.
Une orbitale atomique
indique la probabilité de présence d'un électron autour du noyau d'un atome isolé
-
le volume des orbitale est indépendant du nombre quantique principal n
;
faux.
n défini en grande partie l'énergie de l'électron ainsi que la taille de
l'orbitale qui augmente à mesure que n
augmente.
- chaque
case quantique correspond à une orbitale atomique ; vrai ;
les cases quantiques
sont les places dans les orbitales atomiques qui peuvent être
occupées par un électron, ou par une paire d'électrons de spin
complémentaires.
Spectre
d'émission de l'atome d'hydrogène.
- la transition la plus énergétique correspond à la série de Lyman
Vrai.
retour sur la couche correspondant à
n=1.
- la transition la
moins énergétique de la série de Paschen correspond à
la transition de n=4 à n = 3 ; vrai ;
-
toutes les transitions appartenant à la série de Pfund correspondent à
un retour de l'électron sur la couche correspondant à n = 4 ; faux.
retour sur la couche
correspondant à n=5.
|
ion
hydrogénoïde .
L'énergie nécessaire pour extraire un électron de l'espèce hydrogénoïde
Be3+ à l'état fondamental et l'amener à l'infini est : 217,6
eV ; 122,4 eV ; 54,4 eV ; 13,6 eV.
EBe3+= EH+ *Z2 avec ici Z =4 ; EBe3+
= 13,6 * 16 = 217,6
eV.
configuration
électronique du carbone.
Quelle est la
configuration du carbone dans sa forme excitée ?
1s2 2s2
2p4 ; Faux.
le carbone compte 6
électrons.
1s2 2s1
2p3 ; Vrai.
1s2
2s2 2p2 ; Faux.
c'est l'état fondamental.
1s2
2s2 2p3 ; Faux.
le carbone compte 6
électrons.
1s2 2s1
2p4 ; Faux.
le carbone
compte 6 électrons.
|
Quelle
est la formule électronique du cobalt (Z=27) ?
1s2 2s2
2p6 3s2 ; Faux.
il n'y a que 12
électrons.
1s2 2s2
2p6 3s2 3p6 4s2 3d7 ; Vrai.
1s2 2s2
2p6 3s2 3p6 4s1.
Faux.
il n'y a que 19 électrons.
1s2
2s2 2p6 3s2 3p6 4s2 3d10 4p5;
Faux.
il y a 35 électrons.
Electrons
célibataires.
Parmi les atomes suivants, quels sont ceux qui possèdent le même nombre
d'électrons célibataires ?
- C ( Z=6) ; Cr ( Z = 24) ; Gd ( Z = 64) ; Cm ( Z = 96).
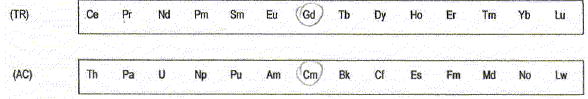
ils doivent appartenir
à la même colonne de la classification périodique comme Gd et Cm.
Cr : 1s2
2s2 2p6 3s2 3p6 4s2 3d4 ; C : 1s2 2s2
2p2 ;
Elément de
nombre atomique Z = 35.
Il appartient à :
- dans le bloc des métaux de transition ; Faux.
1s2,
2s2, 2p6, 3s2 , 3p6 ,
3d10,
4s2 , 4p5 ;
- dans la famille des halogènes ; Vrai.
- dans la famille des alcalins. Faux.
- dans la famille des actinides. Faux.
- dans la famille des gaz rares. Faux.
Claser par
rayon atomique croissant.
Il appartient à :
- Ar ; Mg ; Ca ; Vrai.
..Mg ; Al ; Si ; P ; S ; Cl ;
Ar : au sein d'un période, le rayon atomique décroît de gauche à
droite : rAr < rMg ;
augmentation
de l'attraction noyau électron donc contraction du nuage
électronique
Mg ; Ca : au
sein d'une même famile, le rayon atomique croït de haut en bas : rMg < rCa ;
l'augmentation
de n est plus rapide que celle de Zeff d'où une
dilatation du nuage électronique ;
- Mg ; Ar ; Ca ; Faux.
- Ca ; Mg ; Ar. Faux.
- Mg ; Ca ; Ar. Faux.
Classer par
ordre d'énergie d'ionisation croissante.
- Na+ ; Na ; Ne ; faux ;
l'énegrie de seconde ionisation
est très supérieure à l'énergie de première ionisation : d'où Na
; Na+ ;
- Ne
; Na+
; Na ; faux ;
- Na+ ; Ne ; Na ; faux ;
-
Na ; Na+ ; Ne ; faux ;
- Na ; Ne ; Na+
; vrai.
VSEPR :
géométrie COCl2
: le carbone est l'atome central
- AX3E2. Faux.
le carbone ne possède pas de
doublet non liant ;
- AX2. Faux.
le carbone est lié à tois autres
atomes ;
- AX3E. Faux.
- AX3.
Vrai.
VSEPR :
géométrie CH3+
:
- AX3E2. Faux.
le carbocation est plan ;
- AX2. Faux.
le carbone est lié à tois autres
atomes ;
- AX3E. Faux.
- AX3. Vrai.
VSEPR :
géométrie H3S+
: le soufre est l'atome central
- AX3E2. Faux.
- AX2. Faux.
le soufre est lié à tois autres
atomes ;
- AX3E. Vrai.
- AX3. Faux.
VSEPR :
géométrie HCN : le
carbone est l'atome central
- AX3E2. Faux.
le carbone ne possède pas de
doublet non liant ;
- AX2. Vrai.
- AX3E. Faux.
- AX3. Faux.
|
Premier principe
de la thermodynamique.
- lors d'une
transformation cyclique, le premier principe de la thermodynamique
permet d'écrire : DU = W+Q ;
Vrai.
La
variation d'énergie d'un système fermé est égale à la quantité
d'énergie échangée avec le milieu extérieur, sous forme de chaleur et
sous forme de travail.
- Dans la relation DU
= W+Q, Q s'exprime en calorie et W en joule
; faux
;
Q et W s'expriment en
joule ;
- Q et W sont des fonctions d'état ; faux
;
Formule
de Lewis HNO3 ; CO2 ; H2NCl.
Parmi les formules suivantes indiquer s'il y en a une ou plusieurs qui
correspondent à la formule de lewis de HNO3 ; CO2 ; H2NCl
?
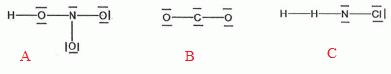
A : formule de Lewis de l'acide nitrique ;
vrai.
B : le carbone ne comporte pas de
doublets non liants ; B est une écriture fausse ;
C : l'atome d'hydrogène ne peut
pas être doublement lié ; C est une écriture fausse ;
Déplacement
d'un équilibre.
Réaction A : SO2(g) +½O2(g) = SO3(g) DH = -98,29 kJ/mol
Réaction B : N2(g) +O2(g)
= 2 NO(g) DH =+179 kJ/mol
- Une augmentation de température sur la
réaction A déplace l'équilibre dans le sens direct. Faux.
DH négatif, réaction exothermique.
- Une augmentation de température sur la
réaction B déplace l'équilibre dans le sens direct. Vrai.
DH positif, réaction endothermique.
- Une augmentation de pression ( par diminution de volume) sur la
réaction A, déplace l'équilibre dans le sens 2. Faux.
A température constante,
l'équilibre A évolue dans le sens d'une diminution du nombre de mole
si la pression augmente.
- Une augmentation de pression ( par
diminution de volume) sur la réaction B, déplace l'équilibre dans le
sens 1. Faux.
Le
nombre total de moles reste constant.
|