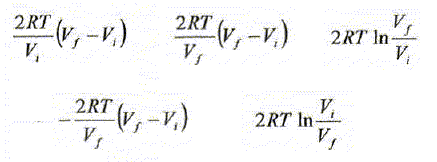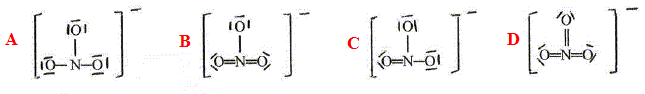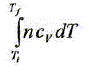Nombre
d'oxydation de l'élément carbone.
Cet élément admet les nombres d'oxydation respectifs {-4 ; +2 ; 0 ; +4
}dans les espèces suivantes :
-
CH4 ; CO ; C ; CO2.
Vrai.
"n.o(H) = +1 et n.o (O)
= -2
; dans une molécule la
somme des nombre d'oxydation est nulle.
- C2H6 ; H2C=O
;
C ; CO2 . Faux.
- CO2
; CO ; C ;
CH4. Faux.
- CO2
; CO ; H2C=O ; CH4.
Faux.
Transfert
thermique.
On plonge une épingle de capacité calorifique C ( J K-1)
dans un verre contenant une masse m ( en gramme) d'eau
chaude à la température T1 supérieure
à Ta, température ambiante.
On note Tf la température finale du système ( masse d'eau + épingle)
supposé isolé et c1 la capacité thermique
massique de l'eau en J K-1 kg-1.
La relation permettant de calculer Tf s'écrit :
m c1(Tf-T1)
=C(Tf-Ta) ; faux
;
La masse doit être
en kg ; (Tf-T1) étant négatif, le membre de
gauche de l'égalité est négatif, celui de droite est positif.
10-3m
c1(Tf-T1)
=C(Ta-Tf) ; vrai ;
10-3m
c1(Tf-T1)
+C(Tf-Ta) = 0 ; vrai ;
m c1(Tf-T1)
+C(Tf-Ta) = 0 ; faux
;
La masse doit être en
kg ;
La
température Tf est comprise entre Ta
et T1 ; vrai.
|
Constante
d'équilibre.
La constante d'équilibre Kp de la réaction
d'équation 2HN3(g) = N2(g)
+ 3H2(g) :
a
l'expression pN2 pH23
/pNH32 . vrai.
p étant les
pressions partielles des gaz.
admet
l'unité atm-2.
Faux.
l'unité
est atm2.
n'a pas d'unité. Faux.
admet
l'unité atm2. vrai.
a
l'expression pNH32 /(pN2
pH23 ) Faux.
|
Oxydoréduction.
Cocher les équations d'oxydoréduction, parmi les équations suivantes :
C(s) + CO2(g)-->
2CO(g). vrai.
n.o(
C dans C(s) ) = 0 ; n.o(C dans CO2) = +4 ; n.o(C
dans CO) = +2 ; le nombre d'oxydation du carbone varie, c'est une
réaction d'oxydoréduction.
FeOH2+
+ 2H2O --> Fe(OH)2+
+H3O+. Faux.
n.o(H) = +1 ; n.o(O) = -2
; dans FeOH2+, n.o(Fe)-2+1= 2 ; n.o(Fe) =+3;
dans Fe(OH)2+, n.o(Fe)+ 2(-2+1)= 1 ; n.o(Fe) =+3;
aucun nombre d'oxydation ne varie, ce n'est pas une réaction
d'oxydoréduction.
HCO3- +H2O
--> CO32-
+H3O+. Faux.
dans HCO3- , n.o(C)+1-2*3=-1 ; n.o(C) = +4
; dans CO32- , n.o(C) -3*2 = -2 ; n.o(C) =+4
aucun nombre d'oxydation ne
varie, ce n'est pas une réaction d'oxydoréduction.
CO2 +3H2O
--> CO32-
+2H3O+. Faux.
aucun nombre d'oxydation ne
varie, ce n'est pas une réaction d'oxydoréduction.
MnO4-
+5 Cu+ + 8H3O+
-->Mn2+ +5 Cu2+ +
12H2O. vrai.
n.o
(Cu) dans Cu+ : +1 ; n.o (Cu) dans Cu2+
: +2 ; au moins un nombre d'oxydation varie, c'est une réaction
d'oxydoréduction.
Nombres
quantiques.
Un électron d'une configuration électronique est associé aux nombres
quantiques n=3, l=1 et m=0. Il appartient :
- à une orbitale 3d. Faux.
pour
une orbitale 3d, la valeur de l est 2.
- à une sous couche p. vrai.
pour une
orbitale p, la valeur de l est 1.
- à l'atome de magnésium ( Z=12) dans son état fondamental. Faux.
Configuration
électronique du magnésium 1s2, 2s2, 2p6, 3s2 , 3p0.
- à l'atome d'azote ( Z=7) dans son état fondamental. Faux.
Configuration
électronique de l'azote 1s2, 2s2, 2p3, 3s0 , 3p0.
- à l'atome de phosphore ( Z=15) dans son
état fondamental. vrai.
Configuration
électronique du phosphore 1s2, 2s2, 2p6, 3s2 , 3p3.
Couche
de valence.
L'atome de nombre atomique Z =52 admet comme configuration de sa couche
de valence, dans l'état fondamental :
- 5s2 ,5p5
. Faux.
1s2, 2s2, 2p6, 3s2 , 3p6 , 3d10,
4s2 , 4p6
, 4d10, 5s2 ,5p4
,
- 5s2 ,5p3
. Faux.
- 5s2 ,5p6
. Faux.
- 5s2 ,5p4
. Vrai.
- 6 s1. Faux.
Tableau
d'avancement.
Décomposition
de n0 moles de trioxyde de xénon en présence de n1
moles de xénon et n2 moles de dioxygène
2XeO3(g) = 2Xe(g) + 3O2(g)
|
avancement
(mol)
|
2XeO3(g) |
= 2Xe(g) |
+ 3O2(g) |
état
initial
|
0
|
n0 |
n1 |
n2 |
en
cours
|
x
|
n0-2x
|
n1+2x |
n2+3x
|
état
final
|
xfin
|
n0-2xfin |
n1+2xfin |
n2+3xfin |
L'élément
chlore ( Z=17) est plus électronégatif :
- que l'élément sodium.
Vrai.
- que
l'élément oxygène. Faux.
- que l'élément fluor. Faux.
- que l'élément soufre.
Vrai.
Formation du sucrose C12H22O11(s).
La réaction de formation du sucrose admet l'équation :
12 C(s, graphite) + 11 H2O
---> C12H22O11(s) .
Vrai.
il y a bien conservation de tous
les éléments.
12 C(s, graphite) + 11 O(g) + 22 H(g)
---> C12H22O11(s). Faux.
L'oxygène atomique
O(g) et l'hydrogène atomique H(g) n'existent pas dans les conditions
habituelles des réactions chimiques.
C6H12O6(s glucose) +C6H12O6(s fructose)
---> C12H22O11(s) + H2O. Faux.
c'est la réaction
inverse, hydrolyse du sucrose, qui se produit.
12 C(s, graphite) +11 / 2 O2(g) + 11 H2(g)
--->C12H22O11(s). Faux.
11 / 2 O2(g) + 11 H2(g) sont très réactifs et
donnent de l'eau.
Compression
réversible de 2 moles de gaz parfait.
La température restant constante, l'énergie interne du gaz ne varie
pas. On note Vi, le volume initial du gaz et Vf
le volume final.
La chaleur reçue lors de cette transformation se calcule par :
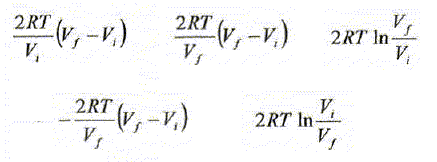
dU =dW+ dQ = 0 ; dQ = -dW et dW=-PdV d'où : dQ =PdV ;
Loi des gaz parfaits : P = 2 RT/V ;
dQ
=2RT / V dV = 2RT d(ln V) ;
intégrer entre Vi et Vf :
Q = 2RT ln (Vf /Vi )
|
Enthalpie
standard de réaction.
L'écart
entre la variation d'enthalpie standard de réaction DrH°et la variation d'énergie
interne standard correspondante DrU° :
- est
proportionnel à la variation du nombre de moles gazeuses de la réaction
;
Vrai.
H = U + PV ; H = U +nRT ; DH = DU + nRDT ; DH - DU = nRDT ;
- est proportionnel à la
variation de température entre l'état initial et l'état final
;
Vrai.
- représente la chaleur reçue
sous pression constante ; faux
;
la chaleur
reçue sous pression constante correspond à l'enthalpie.
- dépend de la température ; faux
;
Charges
formelles dans l'ion nitrate NO3-.
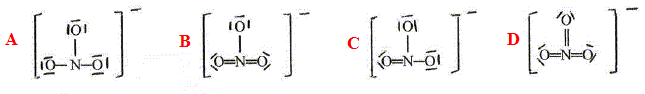
Dans
quell(s) représentation(s), le jeu des charges formelles portées par
les atomes respectifs (N ; O ; O ; O ) est : +1 ; 0 ; -1 ; -1 ?
A : chaque atome d'oxygène porte une charge négative ;
B : un seul atome d'oxygène porte une charge négative ;
C
: deux atomes d'oxygène portent une charge négative, un atome
d'oxyène ne porte aucune charge ; l'atome d'azote porte une charge
positive.
vrai.
D : les atomes d'oxygène ne portent aucune charge.
Variation
d'enthalpie.
Echauffement de n moles de gaz parfait sous pression constante de la
température Ti à la température Tf.
La variation d'enthalpie est :
- inférieure à la variation d'énergie interne. Faux.
DH = nCpDT ; DU = nCvDT ; Cp - Cv= R ;
DH =(n R +nCv)DT ; DH =DU +n RDT avec n RDT positif.
- s'écrit : 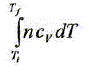 Faux. Faux.
il faudrait remplacer Cv
par Cp.
- est égale à U+PV. Faux.
H = U+PV ;
la variation DH
est différente de U+PV.
- représente la chaleur reçue
par le système.
Vrai.
- est supérieure à la variation
d'énergie interne.
Vrai.
|