Modèle de Rutherford de l'atome d'hydrogène.
- propose un mouvement circulaire uniforme du noyau autour de l'électron. Faux.
" L'électron gravite autour du noyau avec une vitesse uniforme en décrivant une
orbite circulaire".
- calcule une énergie quantifiée. Faux.
- calcule une énergie inversement proportionnelle à la distance noyau-électron. Vrai.
- justifie les niveaux d'énergie discrets. Faux.
Polarités des liaisons.
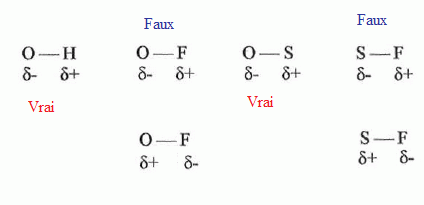
Le fluor est le plus électronégatif des éléments.
|
Acide, base forts ou faible.
L'acide propanoïque C2H5-COOH est faible ; l'acide perchlorique HClO4 est fort ; l'éthanol C2H5-OH est un "acide" spectateur dans l'eau.
C2H5-COO- est une base forte. Faux.
HO- est une base forte ; le pKa du couple acide base H2O/HO- vaut 14 à 25°C.
ClO4- est une base faible. Faux.
ClO4-est une "base" spectateur dans l'eau.
C2H5-O- est une base forte. Vrai.
|
Avancement final xf.
0,05 mole de pentachlorure de phosphore PCl5(g) est en équilibre avec 0,09 mole de trichlorure de phosphore PCl3(g) et 0,05 mole de dichlore Cl2(g) à une température donnée.
On augmente la température et on ajoute 0,04 mole de PCl5(g) et 0,05 mole de Cl2(g).
Lorsque l'équilibre est rétabli, une valeur possible de l'avancement final xf de la décomposition de PCl5(g) en PCl3(g) et Cl2(g) est :
+0,08 ; -0,15 ; -0,08 ; +0,1.
L'avancement d'une réaction est un nombre positif : -0,15 et -0,08 sont donc exclus.
L'avancement final ne peut pas être supérieur à l'avancement maximal, quantité de matière du réactif limitant.
On définit l'état initial de la manière suivante : PCl5(g) : 0,09 mole ; PCl3(g) : 0,09 mole ; Cl2(g) : 0,10 mole avant augmentation de température.
dans l'hypothèse d'une évolution dans le sens direct, PCl5(g) est le réactif limitant ; dans l'hypothèse d'une évolution en sens indirect, PCl3(g) est le réactif limitant.
xf ne peut donc pas être supérieur à 0,09 mol.
Travail des forces de pression.
On note P la pression du système et dV la variation élémentaire du volume du système, -PdV est l'expression :
- du travail des forces de pression pour une transformation élémentaire. Faux.
dW = -Pextérieure dV.
- du travail net. Faux.
- du travail des forces de pression pour une transformation irréversible élémentaire. Faux.
- du travail des forces de pression pour une transformation réversible élémentaire. Vrai.
dans ce cas la pression P du système est à chaque instant égale à la pression extérieure.
Eléments soufre et oxygène.
Les éléments S et O appartiennent à la même famille. La molécule H2O est plus légère que la molécule H2S, sulfure d'hydrogène : pourtant H2S est un gaz à température ambiante alors que H2O est un liquide.
- ceci explique que les interactions de Van der Walls sont plus fortes dans le sulfure d'hydrogène que dans l'eau. Faux.
- ceci s'explique par des liaisons hydrogène intermoléculaires. Vrai.
- la température d'ébullition de l'eau est plus élevée que celle du sulfure d'hydrogène. Vrai.
- la température de fusion de l'eau est plus faible que celle du sulfure d'hydrogène. Faux.
Liaisons hydrogène.
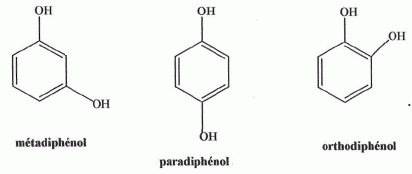
- Le paradiphénol admet une température d'ébullition plus élevée que l'orthodiphénol. Vrai.
- L'orthodiphénol réalise des liaisons hydrogène intramoléculaires. Vrai.
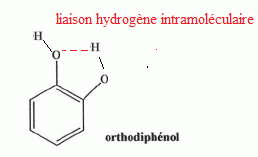
Dans l'orthodiphénol il y a
moins de possibilité de liaisons hydrogène entre molécules : la
température d'ébullition de l'orthodiphénol est donc plus faible que
celle du paradiphénol.
- Le paradiphénol réalise des liaisons hydrogène intramoléculaires. Faux.
- Le métadiphénol réalise des liaisons hydrogène intramoléculaires. Faux.
Variation d'entropie.
- est nulle au zéro absolu. Vrai.
à 0 K, tous les corps purs sont cristallisés et parfaitement ordonnés : leur entropie est nulle.
- est calculable dès que l'on se donne une transformation réversible de l'état initial à l'état final. Vrai.
L'entropie est une fonction
d'état. Sa variation ne dépend que de l'état final et de l'état
initial, peu importe le chemin suivi. On peut donc imaginer une
transformation réversible pour laquelle le calcul de la variation
d'entropie est facile.
- est toujours positive. Faux.
la variation d'entropie d'un système thermodynamique est positive ou nulle.
- est égale à la chaleur reçue que multiplie la température. Faux.
dS = dQrév / T .
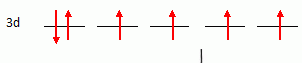
Ion cobalt (III).
Combien d'électron célibataire comporte l'ion Co3+ dans son état fondamental ? On done 27Co. ( 1 ; 2 ; 3 ; 4 ).
Co3+ : 1s2
2s2 2p6 3s2 3p6
3d6 .
Configuration électronique.
La configuration électronique suivante de l'oxygène O :
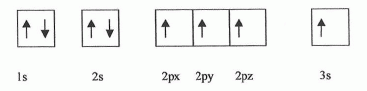
- viole le principe de stabilité de Klechkovsky. Vrai.
Dans l'état fondamental, le remplissage des orbitales par les électrons va
s'effectuer par valeurs croissantes de : n + l. Lorsque n + l est le
même pour deux orbitales, celle qui a la plus petite valeur de n est remplie la
première.
- viole le principe de Pauli. Faux.
Le nombre maximal d'électrons pouvant appartenir à une couche caractérisée par
le nombre quantique n est 2n2. Deux électrons ne peuvent jamais exister dans le même
état quantique c'est à dire avoir leurs quatre nombres quantiques :
n, l, m et s identiques
- est l'état fondamental. Faux.
état fondamental 1s2
2s2 2p4
- viole la règle de Hund. Faux.
Dans
l'état fondamental, lorsque plusieurs orbitales atomiques sont
dégénérées, les électrons occupent d'abord le maximum d'orbitales
possibles et ils prennent des spins identiques.
|
Constante d'équilibre.
La réaction équilibrée d'équation : C(s) + O2(g) = CO2(g) de variation d'enthalpie libre standard DrG°, à la température T, pi étant la pression partielle du constituant i, admet comme constante d'équilibre :

Pile.
Soit la pile : Pt(s) |Sn4+//Sn2+ ||Ag+ |Ag(s).
E°(Ag+ |Ag(s)) = 0,80 V ; E°( Sn4+/ Sn2+) = 0,151 V à 298 K.
DrG°
: enthalpie libre standard de la réaction chimique spontanée
associée à la pile. Les coefficients de l'équation sont des
nombres entiers les plus petits possibles.
- Dans les conditions standard, la réaction spontanée provoque une diminution de la concentration en ion Ag+. Vrai.
Sn2+, réducteur le plus fort s'oxyde : Sn2+ = Sn4++ 2e-.
Ag+ , oxydant le plus fort se réduit : 2Ag+ +2e-= 2 Ag(s).
- Dans les conditions standard, la réaction spontanée provoque une augmentation de la concentration en ion Ag+. Faux.
DrG° = 2 *96500*(0,80-0,151) en joules/mole. Faux.
La réaction étant spontanée, DrG° est négative : DrG° = -2 *96500*(0,80-0,151) en joules/mole.
Acide phosphorique.
L'acide phosphorique est un triacide faible.
- La constante d'acidité Ka du couple HPO42- / PO43- est supérieure à celle du couple H2PO4- /HPO42- . Faux.
Ce serait vrai dans le cas des pKa.
Si les constantes d'acidité associées à H3PO4 sont : Ka1 > Ka2 > Ka3.
- le pH d'une solution de dihydrogénophosphate de sodium H2PO4- +Na+ est :
pH = ½pKa2 + ½pKa3. Faux.
couples acide base : H3PO4 /H2PO4- : pKa1 ; H2PO4- / HPO42- : pKa2 ;
pH = ½pKa1 + ½pKa2.
- le pH d'une solution de phosphate de sodium ( PO43- + 3Na+ ) de concentration molaire c est : pH = ½pKa3-½log c. Faux.
Formule approchée dans le cas d'une base faible : pH = ½(14 +pKa3+log c).
- L'acide H3PO4 est plus fort que l'acide H2PO4- (si on ne considère que ces propriétés acides). Vrai.
H3PO4 /H2PO4- : pKa1 ; H2PO4- / HPO42- : pKa2 ;
Ka1 > Ka2 donc pKa1 < pKa2 ; à concentration égale, l'acide le plus fort a le plus petit pKa.
|





