|
Datation au carbone 14 : concours manipulateur radio St Germain 2010. |
|||||||
|
|||||||
|
Dans la haute atmosphère, soumis au rayonnement cosmique galactique constitué de protons, des neutrons secondaires interagissent avec les noyaux d'azote 14. Cette réaction forme un isotope AZX du carbone : le fameux carbone 14. Immédiatement formé le carbone 14 s'oxyde en se combinant avec l'oxygène pour former du dioxyde de carbone qui se mélange avec le reste de l'atmosphère. Or le carbone 14 est radioactif. La teneur en carbone 14 est constante dans le monde ( dans l'atmosphère comme dans chaque organisme vivant ). Cela est du à un équilibre entre la désintégration et la production de carbone 14. Chaque gramme de carbone contient des atomes de carbone 14. On enregistre en moyenne 13,5 désintégrations par minute et par gramme de carbone. Lorsqu'un arbre, par exemple, est abattu, le bois cesse de vivre, le processus de photosynthèse s'arrête et il n'y a plus d'absorption de dioxyde de carbone. Le carbone 14 est alors libre de se désintégrer sans compensation. On peut donc dater l'âge de la mort de l'organisme ( au moment où cesse tout échange de CO2 avec l'atmosphère). Dans la haute atmosphère la réaction qui a lieu entre le neutron et le noyau d'azote 14 s'écrit : 147N + 10n---> 146C + AZX. Enoncer les lois de conservation et identifier la particule X. Conservation du nombre de nucléons : 14+1 = 14 +A d'où A = 1. Conservation de la charge : 7+0 = 6+Z d'où Z = 1 (élément hydrogène) AZXest un proton 11H. 147N + 10n---> 146C +11H.
Un noyau radioactif est un noyau instable dont la
désintégration (destruction) aléatoire
s'accompagne: Sachant que le carbone 14 présente une radioactivité de type ß-, écrire l'équation traduisant sa désintégration.
On rappelle également la loi de décroissance radioactive. 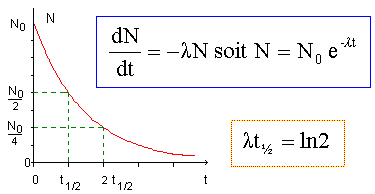 l est la constante radioactive, caractéristique d'un radioélément. Elle s'exprimera ici en an-1.
|
|||||||
| |
|||||||
|
|