Electrolyse de
la solution de bromure de cuivre (II).
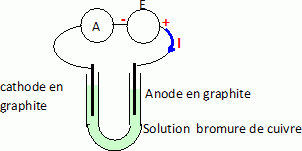
Seuls les ions bromure Br-aq et cuivre (II) Cu2+aq
participent aux réactions aux électrodes.
On donne : 1 F = 9,65 104 C / mol
Ecrire la
demi-équation de la réaction qui a lieu à l'anode ; préciser s'il
s'agit d'une oxydation ou d'une réduction.
A l'anode positive se déroule une oxydation des ions Br-aq :
2Br-aq
= Br2(l) + 2e-.
Même
question pour la cathode.
A la cathode négative se déroule une réduction des ions Cu2+aq :
Cu2+aq
+ 2e-
=Cu(s).
|
Ecrire l'équation de
la réaction d'électrolyse.
2Br-aq + Cu2+aq = Br2(l)+
Cu(s).
|
Etude
quantitative.
L'électrolyse est effectuée pendant Dt
= 1,0 h avec une intensité constante I = 1,00 A.
Donner l'expression
littérale de la quantité d'électricité Q qui a traversé la solution de
bromure de cuivre.
Q = I Dt = 1,00*3600 = 3,6 103
C.
Donner l'expression
littérale de la quantité de de matière
d'électrons qui a été mise en jeu en fonction de Q.
Q = n(e- ) F = 9,65 104 n(e-) ; n(e-) = Q / 9,65 104.
En déduire la
quantité de matière de cuivre qui s'et formée en fonction de I, Dt et F.
Cu2+aq
+ 2e-
=Cu(s) conduit à : n(Cu) = ½n(e-) = ½ Q / F = ½I Dt / F.
A.N : n(Cu) =0,5*1,00 *3600 / 9,65 104 = 1,865 10-2 ~1,9 10-2
mol.
Dans le
cadre d'un projet pluridisciplinaire sur le thème de la spéléologie,
des élèves de terminale doivent faire l'exploration d'un grotte où ils
risquent de rencontrer des nappes de dioxyde de carbone CO2.
A teneur élevée, ce gaz peut entraîner des évanouissements et même la
mort. Le dioxyde de carbone s'est formé par l'action des eaux de
ruissellement acides sur le carbonate de calcium CaCO3
présent dans les roches calcaires. Le professeur de chimie leur propose
d'étudier cette réaction.
Dans un ballon, on réalise la réaction entre le carbonate de calcium et l'acide chlorhydrique ( H3O+aq+ Cl-aq ). Le dioxyde de carbone formé est recueilli par déplacement d'eau dans une éprouvette graduée.
Un élève verse dans le ballon un volume VS =100 mL d'acide
chlorhydrique à 0,1 mol/L. A la date t=0, il introduit rapidement
dans le ballon 2 g de carbonate de calcium tandis qu'un camarade
déclenche un chronomètre. Les élèves relèvent le volume VCO2
de dioxyde de carbone dégagé en fonction du temps. Puis après avoir
calculé les valeurs de l'avancement, ils ont reportés les résultats sur
le graphe x = f(t).
La réaction chimique étudiée paeut être modélisée par l'équation :
CaCO3(s) + 2 H3O+aq = Ca2+aq + CO2(g) + 3 H2O(l).
Déterminer les quantités de matière initiales de chacun des réactifs.
n(H3O+aq) = 0,1 VS = 0,1*0,1 = 0,01 mol.
M(CaCO3) = 40 +12+3*16 = 100 g/mol ; n(CaCO3) = m / M = 2,0 / 100 = 0,02 mol.
Dresser le tableau
d'avancement. En déduire xmax et le réactif limitant.
|
avancement
(mol)
|
CaCO3(s)
|
+ 2 H3O+aq |
= Ca2+aq | + CO2(g) |
+ 3 H2O(l) |
initial
|
0
|
0,02
|
0,01
|
0
| 0
|
solvant
|
en
cours
|
x
|
0,02-x
|
0,01-2x
|
x
| x
|
en large
|
final
|
xmax
|
0,02-xmax |
0,01-2xmax |
xmax | xmax |
excès
|
Si CaCO3(s) est en défaut : 0,02-xmax=0 ; xmax=0,02 mol ;
si H3O+aq est en défaut : 0,01-2xmax=0 ; xmax=0,005 mol ; on retient la plus petite valeur ( H3O+aq est le réactif limitant ).
|
Donner l'expression de la vitesse volumique de la réaction en fonction de l'avancement x et du volume VS de solution.
v(t) = 1/ VS dx/dt.
Comment varie la vitesse volumique de la réaction au cours du temps ? Justifier.
La
concentration des réactifs, facteur cinétique, diminue au cours du
temps. En conséquence la vitesse de la réaction diminue au cours du
temps.
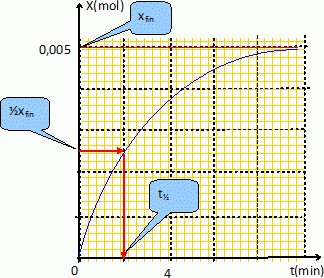
Définir le temps de demi-réaction t½ et le déterminer graphiquement.
Le temps de demi-réaction est la durée au bout de laquelle l'avancement est égal à la moitié de l'avancement final.
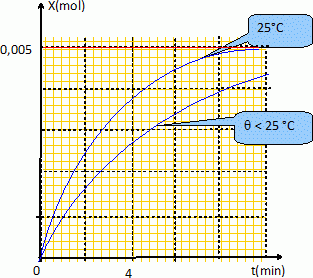
La température de la grotte qui doit être explorée par les élèves est inférieure à 25°C.
Quel est l'effet de cet abaissement de température sur la vitesse volumique de la réaction à la date t=0 ?
La température est un facteur cinétique ; la vitesse de la réaction diminue si la température décroït.
Tracer l'allure de l'avancement en fonction du temps dans ce cas.
|


